- Salz
Salz (Kochsalz, Natriumchlorid, Chlornatrium NaCl; hierzu Tafel »Salzgewinnung I u. II«) findet sich in fast allen Sedimentformationen, im Quartär vielfach als Wüsten- oder Steppensalz, in den übrigen als Steinsalz. Zum Tertiär gehören Steinsalzlager in Italien, in den Karpathen, in Ungarn, Siebenbürgen, in der Schweiz, in Spanien etc. Wenig bedeutend sind die Salzlager der Kreide, in Deutschland entspringen der großen, über dem Steinkohlengebirge Westfalens gelegenen Kreidemulde zahlreiche Solquellen. Zum Jura gehört das Salzvorkommen von Bex im Rhonetal. Die wichtigsten salzführenden Formationen sind die Trias und der Zechstein; ihnen gehören die mächtigen Salzlager in Deutschland, in den Alpen und in England an. Im Keuper liegen die Salzlager von Vic und Dieuze in Deutsch-Lothringen, von Varangéville in Ostfrankreich, von Lancaster, Cheshire und Worcestershire, bei Lawton und Stoke Prior in England; auch die Sol quellen von Luisenhall bei Göttingen, von Egestorffshall, Neuhall und Georgenthal bei Hannover entstammen dem Keuper. Der Muschelkalk weist sehr viele Salzlager auf, so in Süddeutschland zu Friedrichshall bei Jagstfeld, Klemenshall, Ludwigshall und Rappenau bei Heilbronn, Wilhelmsglück bei Hall, Wimpfen, Dürrheim, Sulz, Stetten; in Berchtesgaden mit Frauenreuth, Reichenhall; in Österreich bei Hallstatt, Ischl, Aussee, Hallein am Dürnberg, Hall in Tirol; in Norddeutschland bei Erfurt, Buffleben, Stotternheim, in Deutsch-Lothringen bei Saaralbien. Der Buntsandstein schließt Steinsalzlager bei Arnstadt und Schönebeck ein; Solquellen entströmen demselben bei Schöningen in Braunschweig, in Heinrichshall bei Gera, in Arnstadt, Liebenhall bei Salzgitter und in Sülbeck zwischen Harz und Hildesheim. Die mächtigen Salzlager der Norddeutschen Tiefebene östlich von der Weser liegen im Zechstein, so die Lager von Staßfurt, Westeregeln, Vienenburg, die Lager in Brandenburg (bei Sperenberg südlich von Berlin über 1273 m mächtig erbohrt), in Posen (Hohensalza) bis zur russischen Grenze. Auch zu Segeberg in Holstein und zu Wapno bei Exin in Posen sind Salzlager des Zechsteins nachgewiesen, und die Salzquellen von Halle, von Dürrenberg, Teuditz und Kötzschau, von Salzungen etc. entnehmen ihren Salzgehalt Steinsalzablagerungen des Zechsteins. Im Steinkohlengebirge kennt man Solquellen bei Dudweiler, in Northumberland, Durham, besonders aber in Virginia. Das Devon weist Salzquellen auf in Litauen, bei Altensalz im Vogtland, zu Werdohl in Westfalen und in Nauheim. Das Silur führt S. namentlich in Nordamerika. Vorsilurische Schichten sind in Ostindien salzführend. Auch in kristallinischen Gesteinen kommen Solquellen vor, so im Porphyr bei Münster am Stein und bei Kreuznach (Theodorshall und Karlshall), im Syenit zu Rio Grande und Guaca, im Glimmer- und Hornblendeschiefer in Neugranada. Gelöst findet sich S. im Meerwasser, in vielen Salzseen (Eltonsee, Inderskischer See, Bogdosee, Aralsee, Balchaschsee, Totes Meer, Seen im südlichen Algerien, See von Katwee, Utah), in manchen Flüssen (Carisascha, der in den Eltonsee mündet, Rio ensalado in Chile), geringe Mengen von S. fast in jedem Fluß-, Quell- und Brunnenwasser, in Ackererde, in Pflanzen und Tieren, in deren Organismus es eine große Rolle spielt.
Die Salzseen verdanken ihren Salzgehalt nicht einer marinen Abstammung oder der Auslaugung benachbarter Salzlager, sondern den Salzen der sie speisenden Gewässer. Der Boden der Steppen und Wüsten ist stark salzhaltig, und jeder Regenguß führt dem See S. zu. Beim Verdunsten des Wassers an der Oberfläche der Seen entsteht eine konzentriertere Lösung, die zu Boden sinkt, und hier wird die Konzentration schließlich so groß, daß sich S. ausscheidet. Auf diese Weise sind zahlreiche Steinsalzlager der verschiedenen Formationen entstanden. So gewaltige Lager aber wie das Staßfurter, das bei einer Ausdehnung von vielen tausend Quadratkilometern eine Dicke von 1000 m besitzt (das Steinsalzlager von Sperenberg unweit Berlin ist noch mächtiger), dürften aber andern Verhältnissen ihren Ursprung verdanken, nämlich der Abtrennung eines Meeresteils, in den der Verdunstung entsprechend beständig Meerwasser einströmt, so daß schließlich eine Sättigung mit S. entsteht.
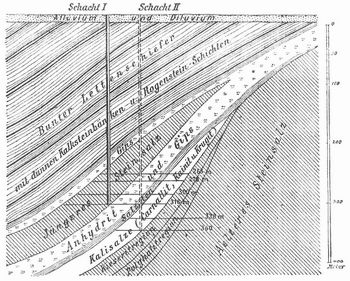
Derartige Verhältnisse zeigt der Karabugas (Adschidarja), ein an der Ostseite des Kaspisees in einem nahezu regenlosen Gebiet gelegenes, 18,000 qkm großes, flaches, durch eine schmale sandige Nehrung vom Kaspisee getrenntes Haff. Nur durch eine schmale Rinne in der Nehrung steht das Haff mit dem See in Verbindung, erhält aber sonst keinen Zufluß. Das Wasser des Adschidarja enthält über 18 Proz. Salze, und am Boden hat sich ein Salzlager gebildet, während das Wasser eine gesättigte Mutterlaugensalzlösung darstellt. Denn da das Meerwasser neben Chlornatrium noch viele andre Salze enthält, so mußten sich zunächst die schwerer löslichen abscheiden (schwefelsaurer Kalk als Gips oder Anhydrit), dann Chlornatrium und schließlich die Salze, die leichter löslich sind als Chlornatrium. Dies sind die sogen. Abraumsalze, Kalium- und Magnesiumsalze, die sich namentlich bei Staßfurt wohl ausgebildet zeigen. Den meisten Steinsalzlagern fehlen die Abraumsalze, und man muß annehmen, daß es gar nicht zu ihrer Ausscheidung gekommen ist, weil nach Ablagerung des Steinsalzes durch Meereseinbruch oder Abfluß der Mutterlauge der Prozeß unterbrochen wurde, oder weil die abgelagerten Salze durch eindringende Tageswasser wieder gelöst und fortgeführt wurden. Bei Staßfurt liegen die verschiedenen Salze genau in der ihrer Löslichkeit entsprechenden Reihenfolge übereinander und sind durch eine Tonschicht vor der Einwirkung von Wasser geschützt. Wenn dann über diesem Lager noch einmal Gips, bez. Anhydrit und örtlich ein jüngeres Steinsalzlager folgt, so deutet dies auf eine mit der Bildung des ältern Salzlagers in keinem ursachlichen Zusammenhang stehende erneute Überflutung durch salzige Wasser. Das Profil (Fig. 1) zeigt die beiden Salzlager und die Schichten der Abraumsalze. Von den Schächten aus bilden Querschläge die Verbindung mit den Abbauen im Steinsalz und Kalisalz, und rechtwinklig von diesen verlaufen dann, nach beiden Seiten dem Streichen des Lagers folgend, die eigentlichen Abbausohlen.
Die Salzlager werden in sehr ungleicher Weise ausgebeutet. Die wichtigsten Salzgewinnungsstätten in Deutschland und Österreich sind:
Deutschland (vgl. Karte »Nutzbare Mineralien in Deutschland« im 4. Bd.). Steinsalz- und Kalisalzbergwerke: Staßfurt, Schönebeck, Löderburg, Westeregeln, Aschersleben, Bernburg, Bienenburg, Anderbeck, Thiede, Sondershausen, Erfurt, Hohensalza (Inowrazlaw), Stetten in Hohenzollern, Wilhelmsglück und Friedrichshall in Württemberg, Heilbronn, Berchtesgaden. Siedesalz aus Solquellen wird gewonnen in etwa 60 Salinen, von denen die wichtigsten sind: Schönebeck, Dürrenberg, Artern, Halle, Stotternheim, Buffleben und Pöhlitz in Thüringen, Neusulza, Salzungen, Luisenhall bei Göttingen, Salzderhelden, Sülbeck, Schöningen, Egestorffshall, Neuhall und Georgenhall bei Hannover, Kampe bei Stade, Königsborn bei Hamm, Sassendorf bei Soest; Nauheim, Ludwigshall bei Wimpfen; Dürrheim und Rappenau in Baden; Saaralben, Salzbronn, Chambrey, Chateau-Salins und Dieuze in Lothringen.
Österreich. Salzbergwerke: Hallstatt, Ischl, Hallein, Aussee und Hall im Salzkammergut; Wieliezka, Bochnia und Kalusz in Galizien; Kazynka in der Bukowina; Akna Szlatina, Ronaszek und Szugatag in der Marmaros (Ungarn); Maros-Ujvar bei Zalathna (Salzmenge auf 100 Mill. Ton. geschätzt), Drésakna (800 Mill. T.), Parajd (950 Mill. T.), Thorda (800–900 Mill. T.) und Vizakna in Siebenbürgen. Salinen: neun in Ostgalizien (mit einer Jahresproduktion von etwa 50,00 T.). Soovar in Ungarn, Siminham und Dolnja-Tuzla in Bosnien. In Istrien und Dalmatien Meersalzgewinnung in fünf Meersalinen.
Über den Abbau des Steinsalzes und die Gewinnnun von S. aus Lösungen s. die beifolgenden Tafeln.
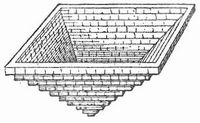
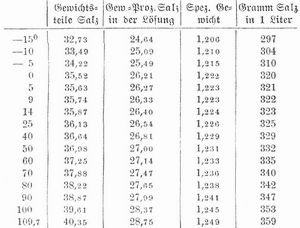
S. kristallisiert in wasserfreien Würfeln, die gern etwas Mutterlauge einschließen und daher beim Erhitzen zerspringen (verknistern, dekrepitieren). An der Oberfläche der Lösungen entstehende Kristalle sind durchscheinend trübe und lagern sich in Form vierseitiger, innen hohler und treppenförmiger Pyramiden (Fig. 2) aneinander. Klare Würfel entstehen bei freiwilliger Verdunstung einer Salzlösung am Boden des Gefäßes. Unter besondern Verhältnissen entstehen auch Oktaeder und Würfeloktaeder. Bei einer Temperatur unter -10° kristallisiert S. mit 2 Molekülen Wasser in großen sechsseitigen Tafeln, die beim Erwärmen in Wasser und Würfel zerfallen. Reines S. wird an der Luft nicht feucht (nimmt aber in feuchter Luft 0,5 Proz. Wasser auf, die es in trockener wieder verliert). Es schmilzt bei 815,4° und verdampft bei höherer Temperatur, namentlich in einem Luftstrom; beim Erstarren kristallisiert es in Würfeln. Sein spezifisches Gewicht ist 2,15. Es ist bei Siedehitze nur wenig löslicher als bei gewöhnlicher Temperatur; 100 Teile lösen Wasser bei:
1 Teil S, löst sich bei:
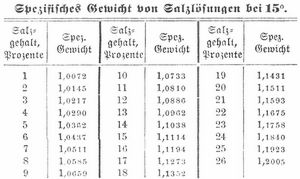
Die Löslichkeit ist etwas größer bei 20 und 40 Atmosphären Druck, sie wird auch durch Gegenwart fremder Salze erhöht. Gesättigte Lösung zieht an der Luft Wasser an. Die bei 107,9° gesättigte Lösung mit 29,5 Proz. S. siedet bei 109°. Ungesättigte Kochsalzlösungen lassen sich durch Gefrieren konzentrieren, indem sich bei niedriger Temperatur salzfreies Eis abscheidet. Die Eisbildung erfolgt stets erst bei Temperaturen unter dem Gefrierpunkt des Wassers und zwar bei um so niedrigern Temperaturen, je konzentrierter die Salzlösung ist. Eine Lösung mit 26 Proz. S. gefriert erst bei -18,43°. Konzentriertere Lösungen scheiden beim Erkalten S. aus, bevor sie gefrieren. Bei der Lösung von S. in Wasser findet geringe Kontraktion statt.
Bei 15° löst Spiritus verschiedener Stärke:
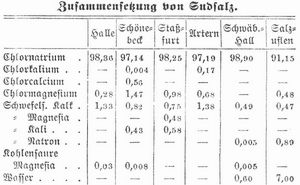
Steinsalz ist bisweilen ganz reines Chlornatrium (Wieliczka) oder enthält doch nur Spuren von Gips (Friedrichshall), häufiger auch geringe Mengen andrer Sulfate und Chloride. Sudsalz enthält fast immer geringe Mengen von Sulfaten und Chloriden des Natriums, Calciums, Magnesiums und Kaliums, seltener und nur spurenweise Eisenchlorid, Alkalibromid und -Jodid. Durch den Gehalt von Chlorcalcium und Chlormagnesium wird es leicht feucht. Der Wassergehalt soll nicht 6 Proz. übersteigen.
Das steuerfreie Kochsalz, das in der Industrie etc. Anwendung findet (Gewerbe- und Viehsalz), wird häufig auf Anordnung der Staatsbehörden zum Gebrauch als Nahrungsmittel untauglich gemacht, denaturiert (s. Denaturieren).
Bedeutung, Verwendung, Produktion etc.
Das S. ist im tierischen Organismus allgemein verbreitet und findet sich in den Flüssigkeiten von allen mineralischen Stoffen in größter Menge. Dabei ist seine Menge im Blut eine ziemlich konstante und von dem Kochsalzgehalt der Nahrung unabhängig. Es findet sich aber hauptsächlich in der Blutflüssigkeit und nur in sehr geringer Menge in den Blutkörperchen; auch sonst ist seine Verteilung im Körper eine sehr eigenartige, und besonders reich an S. sind Speichel, Magensaft, Schleim, Eiter und entzündliche Exsudate. Alles S. des Körpers stammt aus der Nahrung und verläßt den Körper mit dem Harn, den Exkrementen, Mund- und Nasenschleim, Tränen und Schweiß. Ein erwachsener Mann von 64 kg Körpergewicht scheidet in einem Tage nur durch den Harn 11,9 g aus, ein Teil des aufgenommenen Salzes wird aber im Körper in andre Verbindungen umgewandelt. Das S. wirkt im Körper zunächst durch seinen bedeutenden Einfluß auf die Diffusionsvorgänge: es ist ein Hauptfaktor für die Bewegung der Flüssigkeitsmassen im Körper. Ein Zusatz von S. zu den Speisen befördert deren Verdauung, und der menschliche Instinkt hat diesen Zusatz als etwas Unentbehrliches zu allen Zeiten und bei allen Völkern herausgefühlt. Es ist bemerkenswert, daß unter den Tieren nur die Pflanzenfresser ein Bedürfnis nach Chlornatrium zeigen, nicht aber die Fleischfresser. Dies hängt von der Zusammensetzung der Asche der Nahrungsmittel ab, und unter Berücksichtigung des Verhaltens der Aschebestandteile zueinander ergibt sich, daß die Bedeutung des Salzes für Pflanzenfresser und für den Menschen darin zu suchen ist, daß es sie in den Stand setzt, den Kreis ihrer Nahrungsmittel zu erweitern. In chemischer Hinsicht liefert das S. im Organismus die Salzsäure des Magensaftes und vielleicht auch das Natron der Galle; es scheint in sehr inniger Beziehung zum Zellenbildungsprozeß zu stehen und wird bei gehinderter Zufuhr vom Organismus sehr fest zurückgehalten. Man schätzt den Bedarf eines Menschen an S. jährlich auf 7,75 kg. In der Technik benutzt man S. zur Herstellung von Natrium, Soda, Glaubersalz, Chlor, Salzsäure, in der Glas- und Tonwarenfabrikation (zu Glasuren), zur Herstellung von Teerfarben, zur chlorierenden Röstung von Silbererzen und armen Kupfererzen (Kiesabbränden), beim Amalgamationsprozeß, in Eisenhütten und Maschinenfabriken, zum Härten von Stahlwaren, in der Seifenfabrikation, Gerberei, Bleicherei, Färberei, Zeugdruckerei, zum Raffinieren von Fetten, zur Herstellung von Tabakfabrikaten, Mineralwässern, zu Kältemischungen, zum Auftauen von Eis, zum Konservieren von Schiffbauholz, Eisenbahnschwellen und Häuten, zum Einsalzen der Fische, des Fleisches, der Butter, als Dünger (s. d., S. 280) und bei der Viehfütterung. Arzneilich dient S. zu Bädern (Solbäder) und Inhalationen.
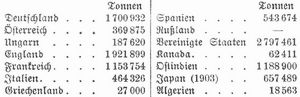
Die Salzproduktion betrug 1904:
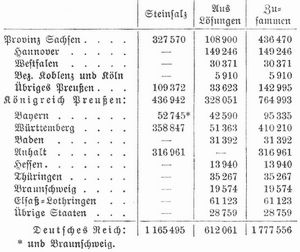
Produktion im Deutschen Reich 1905 (in Ton.):
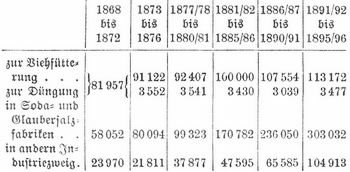
Eingeführt wurden 1905: 207,263 dz und ausgeführt 2,842,028 dz. Der aus Produktion, Aus- und Einfuhr sich ergebende Verbrauch auf den Kopf der Bevölkerung betrug 1891–95 in Kilogrammen: in England 36,7, Frankreich 21,3, Deutschland 17,9, Vereinigte Staaten 25,9, Österreich-Ungarn 14,2, Rußland 11,6. Der relative Salzverbrauch zu Speisezwecken betrug 1897: 7,8 kg und ist seit 1870 fast vollständig gleich geblieben. Dagegen ist der Verbrauch für steuerfreie Zwecke nahezu auf das Dreifache gestiegen. Er betrug in Tonnen:
Der Verbrauch in der Soda- und Glaubersalzfabrikation hat sich mehr als verfünffacht, der in andern Industriezweigen (chemischen Fabriken, Seifenfabriken, Glashütten, Leder- und Gerberindustrie) nahezu versiebenfacht. Der Verbrauch in der Landwirtschaft ist fast gar nicht gestiegen, obwohl das Viehsalz im Interesse einer rationellen Ernährung des Viehes eine erheblich stärkere Verwendung finden müßte.
Die Gewinnung des Salzes war früher meistens regalisiert, d.h. sie wurde als ein Vorrecht des Staatsfiskus in Anspruch genommen, der dann die Ausbeute (Salzgerechtigkeit) regelmäßig gegen bestimmte Abgaben an Private verlieh, und zwar erstreckte sich das Salzregal sowohl auf Steinsalz, indem es insoweit auch einen Teil des Bergregals überhaupt bildete, als auch auf die Salzquellen (sogen. Salinenregal); doch ist es inzwischen, wie die meisten Regalien, durch die moderne Gesetzgebung beseitigt worden. Ebenso ist in Deutschland das Salzmonopol, d.h. die ausschließliche Berechtigung des Staates zum Salzverkauf, abgeschafft und seit 1867 eine Verkaufssteuer eingeführt (s. Salzsteuer). Bei der Wichtigkeit und Notwendigkeit des Salzes erscheint das sogen. Salzhoheitsrecht, das in einer besondern Beaufsichtigung der Salzwerke durch den Staat besteht, als gerechtfertigt. Es erstreckt sich namentlich auf die Genossenschaften (Pfännerschaften), welche die Ausbeutung der Solen betreiben. Die Anteile der einzelnen Pfänner an der Saline, deren meistens 111 unterschieden werden, heißen Pfannen, auch Koten (»Kote«, eigentlich soviel wie Siedehaus) oder Salzkörbe. Zuweilen kommen auch noch die Bezeichnungen Salzbeerbte, Salzherren, Erbsälzer, Salzjunker für diejenigen Inhaber von Salzwerken vor, die ihr Recht nicht durch eine Belehnung erhalten haben, während man den mit der Wahrnehmung der landesherrlichen Gerechtsame in Ansehung eines Salzwerkes betrauten Beamten früher Salzgraf zu nennen pflegte. Vgl. Meyn, Das S. im Haushalt der Natur und des Menschen (Leipz. 1857); Hehn, Das S. (2. Aufl., Berl. 1901); Möller, Das S. in seiner kulturgeschichtlichen und naturwissenschaftlichen Bedeutung (das. 1874); Schleiden, Das S., seine Geschichte, Symbolik und Bedeutung im Menschenleben (Leipz. 1875); A. Schmidt, Das S., eine volkswirtschaftliche und finanzielle Studie (2. Aufl., das. 1874); Schwarz, Vorkommen und Bildung des Steinsalzes (Halle 1885); Glinzer, Das S., seine Gewinnung und Verwendung (Hamb. 1887); v. Kralić, Die Verbreitung des Stein-, bez. Kalisalzlagers in Norddeutschland (Magdeb. 1894; 2. Aufl., Wien 1903); vant'Hoff, Die Untersuchungen über Bildungsverhältnisse der ozeanischen Salzablagerungen (Berl., seit 1897) und Zur Bildung der ozeanischen Salzablagerungen (Braunschw. 1905 ff.); v. Buschman, Das S., dessen Vorkommen und Verwertung in sämtlichen Staaten der Erde (bisher nur Bd. 2, die fremden Erdteile, Leipz. 1906); Karsten, Salinenkunde (Berl. 1846–47, 2 Bde.); Kerl, Salinenkunde (Braunschweig 1868); Hrdina, Geschichte der Wieliczkaer Saline (Wien 1842); Kopf, Beschreibung des Salzbergbaues zu Hall in Tirol (Berl. 1841); v. Schwind, Der Abbau unreiner Salzlagerstätten in Österreich (Prag 1870); Niedžwiedzki, Beitrag zur Kenntnis der Salzformation in Wieliczka und Bochnia (Lemb. 1884–91, 5 Tle.); Precht, Die Salzindustrie von Staßfurt und Umgegend (5. Aufl., Staßf. 1891); Baltz von Balzberg, Die Siedesalzerzeugung (Berl. 1896); Fürer, Salzbergbau- und Salinenkunde (Braunschw. 1900), daraus in Sonderausgabe die Übersichtskarte der Salzwerke und Salinen (das. 1900), und die Literatur bei Artikel »Kalisalze«.
http://www.zeno.org/Meyers-1905. 1905–1909.