- Salzsäure
Salzsäure (Chlorwasserstoffsäure), eine Lösung von Chlorwasserstoff in Wasser. Chlorwasserstoff HCl findet sich in den Gasen, die manche Vulkane aushauchen, auch gelöst in Quellen, die auf vulkanischem Boden entspringen, und in geringer Menge als wesentlicher Bestandteil des Magensaftes, entsteht direkt aus Chlor und Wasserstoff, die sich im Sonnenlicht unter Explosion (Chlorknallgas), im zerstreuten Tageslicht allmählich, aber nicht im Dunkeln verbinden. Auch der elektrische Funke, Platinschwamm oder eine Flamme bewirken die augenblickliche Vereinigung beider Gase. Chlorwasserstoff entsteht außerdem sehr allgemein bei Einwirkung von Chlor auf Wasser und organische wasserstoffhaltige Körper (z. B. Terpentinöl), von Sauerstoffsäuren auf Chlormetalle und oft auch bei der Zersetzung von Chlorverbindungen durch Wasser. Dargestellt wird er durch Behandeln von Chlornatrium (Kochsalz) mit Schwefelsäure, wobei schwefelsaures Natron entsteht und Chlorwasserstoff entweicht. Chlorwasserstoff ist ein farbloses Gas, riecht stechend, bildet an der Luft dichte Nebel, indem er die Feuchtigkeit der Luft anzieht, besitzt das spez. Gew. 1,269; er ist nicht brennbar, reagiert stark sauer und wird bei 10° durch einen Druck von 40, bei -4° durch einen Druck von 25 Atmosphären zu einer farblosen Flüssigkeit verdichtet, die bei -83,7° siedet und bei niederer Temperatur zu einer bei -111,1° schmelzenden kristallinischen Masse erstarrt. Er wird durch Hitze nicht zerlegt, bildet mit vielen Metalloxyden Chlorid und Wasser, mit Metallen Chlorid und Wasserstoff, mit Ammoniak dichte Nebel von Salmiak (Ammoniumchlorid), und wenn man ihn mit Sauerstoff oder Luft erhitzt, so entsteht Chlor und Wasser. Alkohol absorbiert sehr reichlich Chlorwasserstoff unter Bildung von Äthylchlorid; alkoholische Lösungen vieler Säuren liefern bei Behandlung mit Chlorwasserstoff zusammengesetzte Äther. Sehr energisch und unter starker Erhitzung wird Chlorwasserstoff von Wasser absorbiert, und diese Lösung bildet die Chlorwasserstoffsäure oder S. Diese entsteht als Nebenprodukt in der Sodafabrikation bei der Zersetzung von Chlornatrium mit Schwefelsäure. Das aus dem Muffelofen entweichende Chlorwasserstoffgas enthält wenig Luft und wird deshalb von Wasser sehr leicht absorbiert, auch ist es reiner, namentlich von Schwefelsäure, als das aus den Öfen, in denen der Prozeß vollendet wird, entweichende, mit viel Luft gemischte Gas. Man behandelt deshalb beide Gasströme gesondert. Die Gase werden in Rohrleitungen gut abgekühlt, passieren einen kleinen Turm mit feuchten Schamottesteinen, auch wohl mit Chlorbaryumlösung, um die Schwefelsäure möglichst abzuscheiden, und durchströmen dann eine Reihe von untereinander verbundenen Töpfen (Bombonnes, Tourills), um endlich in einen Koksturm einzutreten, in dem Wasser herabrieselt. Dies Wasser nimmt Chlorwasserstoff auf und durchfließt dem Gasstrom entgegen die Topfreihen, in denen es sich so stark anreichert, daß man schließlich eine konzentrierte S. von 20–22° B. gewinnt. Man zersetzt das Chlornatrium auch durch Einwirkung von Schwefliger Säure (Kiesröstgase), Luft und Wasserdampf, wobei Chlorwasserstoff entweicht, und in der Kaliindustrie kann man S. aus dem als Rückstand auftretenden Magnesiumchlorid erhalten, das beim Erhitzen mit Wasser in Magnesia und Chlorwasserstoff zersetzt wird.
Rohe S. bildet eine durch Eisengehalt gelb gefärbte, an der Luft rauchende, mit Schwefelsäure, Schwefliger Säure, Chlor. Arsen, Selen verunreinigte Flüssigkeit. Die von Arsen befreite Säure kann zur Gewinnung reiner S. aus Glasgefäßen destilliert werden, auch läßt man konzentrierte Schwefelsäure zufließen und fängt den entweichenden Chlorwasserstoff in Wasser auf. Chemisch reine S. erhält man durch Destillation von Kochsalz mit arsenfreier Schwefelsäure und Wasser, wobei man das entwickelte Chlorwasserstoffgas in destilliertes Wasser leitet. 1 g Wasser löst Chlorwasserstoff
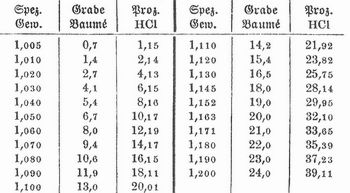
Den Gehalt der reinen S. bei verschiedenem spezifischen Gewicht (bei 15°) zeigt folgende Tabelle:
Reine S. ist farblos, raucht an der Luft, riecht stechend und schmeckt stark sauer; beim Erhitzen gibt starke S. Chlorwasserstoff ab, während sehr schwache S. beim Kochen Wasser verliert und stärker wird. Zuletzt destilliert in beiden Fällen eine Säure, die bei 110° siedet, das spez. Gew. 1,102 besitzt und 20,24 Proz. Chlorwasserstoff enthält. S. löst verschiedene Metalle und Metalloxyde zu Chlormetallen (Chlorüren, Chloriden), gibt mit Schwefelmetallen Schwefelwasserstoff und Chlormetalle, zersetzt Kohlensäuresalze ebenfalls unter Bildung von Chlormetallen und bildet mit den Superoxyden der Alkalien und Erdalkalien Wasserstoffsuperoxyd, mit Blei- und Mangansuperoxyd Superchloride, die sich beim Erwärmen unter Chlorentwickelung zersetzen. Kristallisiertes Glaubersalz wird durch einen Strom von Chlorwasserstoff bei gewöhnlicher Temperatur, entwässertes Natriumsulfat bei Dunkelrotglut vollständig in Chlornatrium und Schwefelsäure zersetzt. Eine Mischung von S. mit Salpetersäure ist das Königswasser. Die S. (Acidum hydrochloricum) des deutschen Arzneibuches besitzt das spez. Gew. 1,124 und enthält 25 Proz. Chlorwasserstoff, die verdünnte S. (A. h. dilutum), aus gleichen Teilen der vorigen und Wasser erhalten, hat das spez. Gew. 1,061. Man benutzt S. zur Bereitung von Chlor, Chlorkalk, chlorsaurem Kali, Bleichsalzen, Salmiak, Chlorbaryum, Chlorzink, Zinnsalz, Chlorantimon, Bleioxychlorid, Chloral, Chloroform, Methyl- und Benzylchlorid, Königswasser, Leim, Phosphor, Superphosphat, gereinigtem Beinschwarz, Kohlensäure etc., in der Teerfarbenfabrikation, zum Reinigen der Knochenkohle in Zuckerfabriken, bei der Verarbeitung der Rübenmelasse, in der Bleicherei, Färberei und Zeugdruckerei, als Beizmittel in der Metalltechnik, zu Kältemischungen, zum Reinigen eisenhaltigen Sandes und Tons für die Glas- und Tonwarenindustrie, zum Reinigen von Koks und Weinstein, zur Abscheidung fetter Säuren aus Seifenwassern zur Gewinnung von Kupfer, Nickel, Kadmium, Wismut auf nassem Wege, zur Reinigung der Eisenerze von Phosphorsäure und der Zinkerze, als Lötwasser, zur Beseitigung des Kesselsteins, zur Verarbeitung der Sodarückstände auf Schwefel etc. Als Arzneimittel dient sie zur Belebung der Verdauung, zur Anregung der Nerventätigkeit bei typhoidem Fieber, Scharlach, Leber-, Nieren- und Magenleiden.
Den bei der Sodafabrikation entwickelten Chlorwasserstoff ließ man anfangs in die Luft entweichen, bis die dadurch hervorgebrachten Übelstände, die durch (150 m) hohe Schornsteine nicht beseitigt werden konnten, die Fabrikanten zwang, den Chlorwasserstoff zu verdichten, wenn auch die gewonnene S. völlig wertlos war. Die Einführung der Kokstürme durch Gossage 1836 brachte wenig Abhilfe, weil die Produktion so stark stieg, daß trotz der bessern Kondensation die Menge des entweichenden Chlorwasserstoffs sich nicht verminderte. Gründliche Abhilfe schuf erst die Alkaliakte von 1863, die verlangte, daß nur 5 Proz. des Chlorwasserstoffs entweichen sollten. Bei der Wertsteigerung der S. gelangte man dann zu einer Kondensation bis auf 1,45 Proz. Deutschland produziert etwa 180,000 Ton. S., 1905 wurden eingeführt 55,937, ausgeführt 126,067 dz. – Die arabischen Chemiker bereiteten Königswasser durch Destillation von Salpeter, Salmiak und Vitriol, kannten aber nicht die S., die zuerst Basilius Valentinus im 15. Jahrh. durch Destillation von Kochsalz mit Vitriol darstellte und Spiritus salis nannte. Glauber erhielt im 17. Jahrh. die Säure aus Kochsalz und Schwefelsäure, Hales stellte zuerst Chlorwasserstoffgas dar, Priestley erhielt dasselbe in reinem Zustand, und Davy zeigte 1810, daß es aus Chlor und Wasserstoff besteht. Vgl. Lunge, Handbuch der Sodaindustrie, Bd. 2 (2. Aufl., Braunschw. 1894); Th. Meyer, Die Fabrikation von Sulfat und S. (Halle 1907).
http://www.zeno.org/Meyers-1905. 1905–1909.