- Aluminĭum
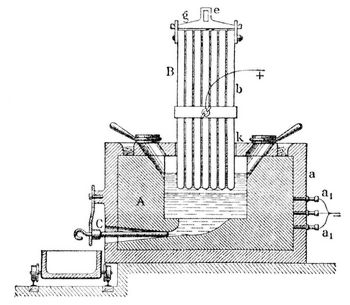
Aluminĭum (v. lat. alumen, Alaun), Al, das Metall der Tonerde, findet sich nicht gediegen, nimmt aber in Form von kieselsaurer Tonerde wesentlichen Anteil an der Bildung der Erdrinde (7,8 Proz.), so fern diese Verbindung den Hauptbestandteil der wichtigsten Mineralien (Feldspat, Glimmer) des Tonschiefers, des Tones, des Lehmes etc. bildet. Außerdem kommt A. als Oxyd und Hydroxyd, als schwefelsaure und phosphorsaure Tonerde, auch als Fluoraluminium (mit Fluornatrium im Kryolith) vor. Zur Darstellung des Aluminiums zersetzte man zuerst Aluminiumnatriumchlorid (aus Bauxit dargestellt), dann auch Kryolith oder Fluornatrium, mit Natrium, gegenwärtig aber wird A. ausschließlich auf elektrolytischem Wege dargestellt, wobei Voraussetzung ist, daß die Elektrizität durch Benutzung großer Wasserkräfte sehr billig gewonnen werden kann. Zur Überwindung der chemischen Energie, die 1 kg A. in der Tonerde an Sauerstoff bindet, ist eine Arbeit erforderlich, die derjenigen entspricht, die 40 Pferde in einer Stunde leisten. In Neuhausen arbeitet man zur Darstellung von A. mit einigen Abänderungen nach dem Verfahren von Héroult und Kleiner-Fiertz, indem man die zu reduzierenden Alkalidoppelfluoride (Kryolith) in Gefäße bringt, deren Wandungen mit Bauxit oder Ton gefüttert sind und in welche die verstellbaren Elektroden von oben und unten einmünden. Der Lichtbogen schmilzt die gepulverten Massen, wobei sich das A. an der untern negativen Elektrode abscheidet, während der Elektrolyt sich durch Aufnahme von Tonerde, die man in angemessener Weise nachfüllt, regeneriert. Den Apparat zeigt die Abbildung auf S. 397. Ein aus Kohlenplatten gebildeter Tiegel A ist von einer fest anschließenden eisernen Hülle a umgeben, die vom Boden isoliert ist. Eine Anzahl kupferner Stifte a, führen den elektrischen Strom dem Tiegel A zu. In letztern taucht die positive Elektrode B, die aus Kohlenplatten b gebildet ist. Diese werden oben durch ein Rahmenstück g zusammengefaßt, und in die Öse e des letztern greift eine Kette ein, mittels welcher die Elektrode gehoben und gesenkt werden kann. Der Tiegel A ist mit Graphitplatten k bedeckt, die einige Öffnungen zur Einführung von Material besitzen. Dieselben werden nach Bedürfnis durch Deckel geschlossen, gestatten aber auch den Abzug der im Tiegel entwickelten Gase. Auf dem Boden des Tiegels liegt eine Metallplatte als negative Elektrode. Durch Annäherung beider Elektroden bringt man die Beschickung zum Schmelzen, worauf man die positive Elektrode hebt, so daß der Strom durch die geschmolzene Tonerde geht, die alsbald zersetzt wird. Das am Boden angesammelte Metall wird durch das Stichloch C abgelassen. Sollen Aluminiumlegierungen dargestellt werden, so wird das betreffende Metall in den Tiegel gebracht und regelmäßig Tonerde nachgefüllt.
In neuester Zeit ersetzt man auch die Tonerde durch Aluminiumsulfid, das bei der Elektrolyse durch die von dem elektrischen Strom erzeugte Wärme selbst oder durch Ofenhitze flüssig erhalten werden kann. Die Reduktion erfolgt bei geringer Stromstärke, und es werden Kurzschlüsse vermieden, weil das A. sofort zu Boden sinkt. Als Lösungsmittel für das Aluminiumsulfid dienen Chlorkalium und Chlornatrium. Die Reduktion wird am besten in einem eisernen Kasten vorgenommen, der oben mit Kohle ausgefüttert ist, und da weder dieses Futter noch die in die geschmolzene Masse eintauchenden Kohleelektroden durch den Elektrolyten schädlich beeinflußt werden, so erhält man reineres A. als früher. Das Aluminiumsulfid erhält man (neben Chlornatrium) beim Eintragen von Natriumaluminiumchlorid in geschmolzenes Natriumsulfid, auch kann man das Sulfid auf diese Weise direkt aus Kryolith darstellen oder Ton mit Schwefelsäure aufschließen, das erhaltene Aluminiumsulfat mit Natriumfluorid schmelzen und das gebildete Natriumsulfat durch Zusatz von Kohle reduzieren. Die Pittsburgh Reduction Co. arbeitet nach dem Hallschen Verfahren, das auf der Löslichkeit der Tonerde in den Doppelfluoriden des Aluminiums und der Alkalimetalle beruht. Die Elektrolyse findet in eisernen Kasten statt, deren Futter aus hartgebackener Kohle als Kathode dient. Von einer kupfernen Stange, die mit dem positiven Pol der Dynamomaschine in Verbindung steht. hängen an Kupferstangen Kohlenzylinder als positive Elektroden herab, die in das Bad eintauchen. Eine zweite Kupferstange ist mit dem negativen Pol der Dynamomaschine verbunden. Bei Beginn der Arbeit bringt man auf den Boden des Kastens ein Flußmittel, das aus einem Doppelfluorid von A. und Calcium und aus Fluorkalium und Fluornatrium mit 3 Proz. Chlorcalcium besteht; ist dasselbe durch die Stromwärme eingeschmolzen, so gibt man Tonerde (aus Bauxit) nach. Durch regelmäßiges Eintragen von Tonerde und Ausschöpfen von A. gestaltet sich das Verfahren zum ununterbrochenen Betrieb.
A. ist weiß mit etwas bläulichem Schein und starkem Metallglanz, härter als Zinn, aber weicher als Zink und Kupfer, läßt sich zu dünnstem Draht, Blech und feinster Folie verarbeiten, zeigt dagegen bei Bearbeitung mit schneidenden Werkzeugen sehr stark die Eigenschaft des Schmierens. Im gegossenen Zustand hat es etwa die Festigkeit von Gußeisen, kalt gewalzt oder geschmiedet erreicht es fast die Festigkeit von gegossener Geschützbronze und übertrifft diejenige von warm gewalztem Kupfer sowie von Zink und Zinn. Es kristallisiert regulär, gegossenes A. bricht meist grobfaserig und unregelmäßig gekörnt; bearbeitetes A. hat sehnigen, oft auch feinkörnigen, seidenglänzenden Bruch. Gutes Metall läßt sich mit dem Meißel durchhauen, ohne zu brechen. Stark gewalzt oder gezogen sedert es sehr gut; es besitzt einen schönen Klang. Spezifisches Gewicht bei 22° gegossen 2,64, gewalzt 2,68, gezogen 2,70. Die Verbrennungswärme beträgt 7140 Wärmeeinheiten (Eisen 1352). Es schmilzt bei 700°, besitzt sehr hohe spezifische und Schmelzwärme, und geschmolzenes A. erstarrt daher sehr langsam. Das Wärmeleitungsvermögen ist etwa doppelt so groß wie dasjenige des Schmiedeeisens und halb so groß wie das des Kupfers. Das elektrische Leitungsvermögen beträgt 36–60 Proz. desjenigen von reinem Kupfer. Nach Gewicht berechnet, besitzt A. von allen Gebrauchsmetallen den geringsten Widerstand. Das lineare Schwindmaß des Aluminiums (möglichst kalt in Sand gegossen) beträgt 1,8 Proz. Reines A. ist geschmack- und geruchlos, ein Gehalt von Silicium aber, den das käufliche Metall gewöhnlich besitzt, gibt ihm den Geruch des Gußeisens. In trockner und feuchter Luft hält sich A. bei gewöhnlicher Temperatur und bei Rotglut unverändert, auch beim Schmelzen überzieht es sich nur mit einem äußerst dünnen Häutchen, selbst bei Weißglut verbrennt es nur oberflächlich. Dagegen verbrennt Blattaluminium schon in der Spiritusflamme mit blendendem Licht. Feiner Draht verbrennt an der Luft zu Aluminiumoxyd und Aluminiumnitrid. Eisenoxyd und Kupferoxyd werden durch A. erst bei sehr lebhafter Rotglut zersetzt. Durch Schmelzen mit Salpeter wird es erst bei lebhafter Rotglut oxydiert, ebenso reduziert es erst bei dieser Temperatur Eisen- und Kupferoxyd. A. ist nicht flüchtig, zersetzt Wasser nur als Blattaluminium und beim Verbrennen in Wasserdampf, aus kochendem Wasser entwickelt A. auf Zusatz einiger Tropfen von übermangansaurem Kali stürmisch Wasserstoff. Es löst sich leicht in Salzsäure und Natronlauge, sehr langsam in verdünnter Schwefelsäure, nicht in Salpetersäure. Mit verdünntem Ammoniak entwickelt A. lebhaft Wasserstoff. Verdünnte Lösungen organischer Säuren wirken in der Kälte nicht auf A., beim Kochen mit kochsalzhaltigen Lösungen organischer Säuren wird es weniger angegriffen als Kupfer. Schweiß, Speichel, Eiter wirken äußerst langsam, Schwefelwasserstoff und Schwefelmetalle gar nicht auf A. Saure Nitrate zersetzt es äußerst langsam, aus Chloriden fällt es schnell das elektronegativere Metall. Beim Schmelzen zersetzt es kohlensaure und schwefelsaure Alkalien augenblicklich, aus Borax und Silikaten nimmt es Bor, resp. Silicium auf, und man kann Verbindungen von 70 Proz. Silicium erhalten. Man schmilzt deshalb A. vorteilhaft in Tiegeln mit Kohlenfutter, wenn es auch kein Silicium aufnimmt, sobald man kein Flußmittel anwendet und nicht weit über den Schmelzpunkt erhitzt. Auch Kryolith wird beim Schmelzen mit A. angegriffen. Mit amalgamiertem Zink gibt es in verdünnter Schwefelsäure ein galvanisches Element, dessen Strom an Intensität wenigstens dem eines Platinzinkpaares gleichkommt. Gegen elektrische Einflüsse zeigt A. eine Widerstandsfähigkeit, welche die des Platins vielleicht noch übertrifft. A. zeigt sich in oben angegebener Weise verhältnismäßig indifferent, weil es stets mit einem unsichtbaren, aber sehr widerstandsfähigen Oxydhäutchen bedeckt ist. Wird letzteres durch Ätzen mit Quecksilberchlorid entfernt, so zeigt sich A. sehr reaktionsfähig, zersetzt Wasser stürmisch und entzündet sich an feuchter Luft. Solches A. muß in einer indifferenten Flüssigkeit aufbewahrt werden und eignet sich als bestes Trockenmittel für organische Flüssigkeiten (Alkohol, Äther), auch wird es als neutrales Reduktionsmittel angewendet. Geschmolzenes A. reduziert energisch die meisten Oxyde. Eine Mischung von Aluminiumpulver mit Eisenoxyd läßt sich durch eine Zündmasse aus Baryumsuperoxyd und Magnesiumpulver entzünden und verbrennt dann unter Temperatursteigerung auf Weißglut. Vgl. Thermit. Das Atomgewicht des Aluminiums ist 27,1. Man kennt vom A. nur ein Oxyd, Aluminiumoxyd oder Tonerde Al2O3.
Das A. des Handels enthält 99,9 Proz. A., 0,06 Proz. Silicium, 0,04 Proz. Eisen, bis 92,84 Proz. A., 3,82 Proz. Silicium, 3,34 Proz. Eisen. Amboßaluminium hat das spez. Gew. 2,3 und besteht aus fast reinem A. mit etwas Eisen und Mangan, sehr wenig Magnesium und Spuren von Silicium und Natrium. Es läßt sich sehr gut bearbeiten, in nassen Sandformen gießen, und stabförmige Gußstücke konnten nach dem Erkalten mehrfach um ihre Achse gedreht werden. Auch ist das Material in kaltem Zustand schmiedbar. Mit 1–2 Proz. Silicium ist A. schon sehr grau, aber in der Kälte noch ziemlich weich und zäh, in der Wärme freilich kaum mehr schmiedbar. Über 2 Proz. Silicium machen das Metall spröde und brüchig. Für die Hämmer- und Walzbarkeit des Aluminiums ist die Verunreinigung mit geringen Mengen von Eisen, und namentlich von Kupfer, noch schädlicher als die mit Silicium. Das Löten des Aluminiums erfordert besondere Sorgfalt. Mit Blattgold und Blattsilber läßt sich A. zwischen zwei auf dunkle Rotglut erhitzten Kolben durch hydraulischen Druck vereinigen. Galvanische Verkupferung und Vernickelung ist nicht haltbar, dagegen läßt sich A. mit Kupfer plattieren, die Bleche (10 mm A. mit 0,1 mm Kupfer) lassen sich wie Kupferbleche auswalzen, löten, pressen, salzen, ziehen, verzinnen, vernickeln, versilbern etc. und sind vielfach besser verwendbar als Aluminiumblech.
Man benutzt A. wegen seiner Leichtigkeit, Zähigkeit und Widerstandsfähigkeit gegen chemische Einflüsse zu allerlei Gebrauchsgegenständen, in der Kunstindustrie, beim Schiffbau, Eisenbahnbau, zu Luftballonteilen, zu Instrumenten aller Art, zu militärischen Ausrüstungsgegenständen, Tischgeräten, Kochgeschirr, zu elektrischen Leitungen statt des Kupfers etc. Aluminiumplatten benutzt die Lithographie statt der Steine (s. Algraphie). Sehr wichtig ist die Verwendung des Aluminiums im Hüttenwesen zur Herstellung dichter Güsse und zur Darstellung von Chrom, Mangan etc. (vgl. Thermit). Blattaluminium fertigt man als Surrogat des Blattsilbers; auf Salinen wird A. zu Siedgerätschaften und Werkzeugen benutzt. Aluminiumpulver dient zu photographischem Blitzlicht. Vielfache Verwendung haben Aluminiumlegierungen gefunden.
A. wurde 1827 von Wöhler entdeckt und mit Alkalimetall aus Chloraluminium abgeschieden; 1854 gelang Bunsen die elektrolytische Darstellung aus Natriumaluminiumchlorid, und um dieselbe Zeit erhielt Deville von Napoleon III. die Mittel zu großartigen Versuchen. In Javelle bei Paris wurde 1855 die fabrikmäßige Darstellung des Aluminiums unternommen, und noch in demselben Jahr erschienen die ersten Barren des »Silbers aus Lehm« auf der Pariser Ausstellung. Seit Mitte der 1880er Jahre hat die elektrolytische Darstellung des Aluminiums die chemische mehr und mehr zurückgedrängt und die Aluminiumindustrie einen Aufschwung genommen wie kaum eine andre Industrie, und zwar entsprechend dem Entwickelungsgang der großen Dynamomaschinen. Die Aktiengesellschaft in Neuhausen wendete zuerst Turbinen zum Betrieb der Dynamomaschinen an. Zu gleicher Zeit wurde in New Kensington (Pennsylvanien) eine Aluminiumfabrik errichtet, die 1895 nach dem Niagarafall verlegt wurde. Die Neuhauser Gesellschaft baute dann eine zweite Fabrik zur Ausnutzung der Strom schnellen bei Rheinfelden. Am Ende des 19. Jahrh. betrug die Jahresproduktion an A. etwa 5–6000 Ton. Die deutsche Einfuhr betrug 1901: 1,089,600 kg, davon kamen 367,500 kg aus der Schweiz, 341,000 kg aus Österreich, 276,800 kg aus den Vereinigten Staaten, 85,700 kg aus Frankreich. Ausgeführt wurden 282,400 kg. Der Preis von 1 kg A. betrug 1856 etwa 300 Mk., 1889: 50,1892: 5,1900: 1,8 Mk. Auf das Volumen berechnet, ist A. kaum teurer als Zink. Vgl. Mierzinsky, Die Fabrikation des Aluminiums und der Alkalimetalle (Wien 1885); Richards, A. its history, occurrence, etc. (3. Aufl., Lond. 1896); Minet, L'A., fabrication, emploi, alliages (Par. 1892–98, 2 Bde.; deutsch, Halle 1902); Heroult, L'A. à bon marché (im »Bulletin de la Soc. de l'industrie minérale«, St.-Etienne 1900).
http://www.zeno.org/Meyers-1905. 1905–1909.