- Salpetersäure
Salpetersäure (Scheidewasser, Aqua fortis) HNO3 findet sich kaum im freien Zustand in der Natur, aber weitverbreitet an Basen gebunden, in Form von Salpetersäuresalzen (Nitraten) besonders dort, wo organische Substanzen verwest sind. In größter Menge findet sich das Natriumsalz (als Chilisalpeter), das Kaliumsalz (Salpeter), das Calcium- und Magnesiumsalz finden sich im natürlichen Salpeter, Ammoniumsalz in den atmosphärischen Niederschlägen (0,1–1 mg in 1 Lit., auch 5–6 mg). Kleine Mengen von Salpetersäuresalzen finden sich in der Ackerkrume, in vielen natürlichen Gewässern, auch in Pflanzen (0,68–2,77 Proz. Kaliumnitrat in getrockneten Blättern), im Harn, Schweiß, Speichel. Schlagen elektrische Funken anhaltend durch ein Gemisch von Sauerstoff und Stickstoff (z. B durch atmosphärische Luft), so entstehen rote nitrose Dämpfe, bei Gegenwart von Wasser und Alkali S. S. bildet sich auch, wenn Wasserstoff, Ammoniak und andre Körper in atmosphärischer Luft verbrennen. Bei den gewöhnlichen Verbrennungsprozessen entsteht salpetersaures Ammoniak. Auch bei Verwesungsprozessen wird S. gebildet. Am häufigsten und reichlichsten entstehen Salpetrige Säure und S. aus Ammoniak, z. B. wenn man Kupferdrehspäne oder Platinschwarz mit Ammoniak befeuchtet der Luft aussetzt. Bei 300° bildet Platinschwamm aus Luft und Ammoniak oder kohlensaurem Ammoniak oder Chlorammonium S.; auch wenn Ammoniak über erhitztes Mangansuperoxyd geleitet wird, bei Behandlung von schwefelsaurem Ammoniak mit chromsaurem Kali und Schwefelsäure, bei Einwirkung von Ammoniak und Luft auf mit Ätzkalilösung befeuchtete Kreide bei 100° entsteht S. Bei der Fäulnis tierischer Stoffe entweicht deren Stickstoff in Form von Ammoniak; sind aber wie im porösen feuchten Boden Basen oder kohlensaure Salze der Alkalien oder alkalischen Erden zugegen, so wird das Ammoniak zu S. oxydiert. Dieser Prozeß wird durch Eisenoxydgehalt des Bodens gefördert. So entsteht der natürliche Salpeter besonders in wärmern Ländern in einem mit organischen Stoffen, Harn oder Exkrementen geschwängerten, Kalk und Alkalien enthaltenden Boden und an Stallmauern. Dieser Prozeß (Nitrifikation) verläuft unter dem Einfluß von Bakterien. Tötet man letztere und entzieht der hinzutretenden Luft die in ihr enthaltenen Keime, so findet keine Salpeterbildung statt. Bei der Nitrifikation wird durch gewisse Mikroben aus Ammoniak zuerst Salpetrige Säure, dann durch andre Mikroben S. gebildet. Auch die langsame Verbrennung des Humus veranlaßt die Oxydation des Ammoniaks im Boden.
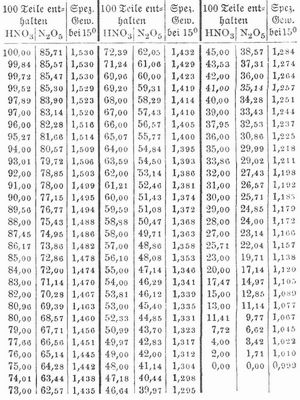
Reine S. HNO3, (Salpetersäuremonohydrat) ist farblos (bei Gehalt an Stickstofftetroxyd gelblich), raucht an der Luft, ist sehr hygroskopisch, riecht schwach, eigentümlich, wirkt außerordentlich ätzend und erzeugt auf der Haut schmerzhafte tiefe Wunden. Das spezifische Gewicht ist 1,559 bei 0°; sie erstarrt bei etwa -50° und siedet bei 86° unter beginnender Zersetzung in Stickstofftetroxyd und Sauerstoff. Dabei steigt der Siedepunkt auf 120°, und es destilliert dann eine Säure 2HNO3+3H2O, die 68 Proz. HNO3 enthält. S. erwärmt sich beim Mischen mit Wasser. Den Gehalt von S. bei verschiedenem spezifischen Gewicht bei 15° zeigt folgende Tabelle:
Zur Darstellung der S. destilliert man salpetersaures Natron (Chilisalpeter) mit Schwefelsäure NaNO3+H2SO4 = HNO3+NaHSO4 und benutzt dazu gußeiserne Zylinder oder Kessel, auch Blasenapparate, die überall von den Feuergasen umspült werden. Bisweilen werden die obern Wandungen der Gefäße mit säurefesten Steinen bekleidet; die Stirnwände bestehen aus Sandsteinplatten. Bei der Destillation entweichen neben den Dämpfen der S. auch Chlor und Jod aus dem Chilisalpeter und Nitrosylchlorid NOCl und Stickstofftetroxyd als Zersetzungsprodukte. Um technisch reine S. zu erhalten, trennt man die im Kondensationsapparat (Tonschlangen) verdichtete S. möglichst schnell von den gasförmigen Nebenprodukten und läßt sie bei 60–80° in die Sammelgefäße fließen, auch bläst man Luft in das Gemenge von Salpeter und Schwefelsäure, um die Gase und Dämpfe möglichst schnell zu trennen. Man erzielt dabei 95 Proz. der theoretischen Ausbeute an sehr konzentrierter chlorfreier S. mit höchstens 1 Proz. Stickstoffoxyden. Die im Kondensationsapparat nicht verdichteten Dämpfe und Gase leitet man durch einen Plattenturm, über dessen Platten Wasser den Dämpfen entgegenströmt. Das als Rückstand der Destillation erhaltene Natriumsulfat wird zur Darstellung von Schwefelsäure oder Salzsäure benutzt. Schließt man an den Destillationsapparat eine Luftpumpe an und destilliert bei einem Vakuum von 500 mm Quecksilber, so bleibt die Temperatur niedrig, es tritt keine Zersetzung von S. ein, und man erhält 99 Proz. der theoretischen Ausbeute und bei Anwendung von trocknem Salpeter und konzentrierter Schwefelsäure wasserfreie S. (HNO3). Nach dem obigen neuern Verfahren hergestellte S. ist für technische Zwecke hinreichend rein, nach älterm Verfahren hergestellte enthält Salpetrige Säure, Stickstofftetroxyd, Chlor, Nitrosylchlorid, auch Jodsäure, Chlorjod, Selenige Säure, Schwefelsäure. Zur Entfernung der gasförmigen Verunreinigungen erhitzt man die rohe Säure auf 60–80° und bläst Luft hindurch (Bleichen, Raffinieren). Sehr hoch konzentrierte S. erhält man durch Destillation mit konzentrierter Schwefelsäure, auch durch Ausfrieren bei etwa -41°. Chemisch reine S. erhält man aus chemisch reinem salpetersauren Kali und reiner Schwefelsäure. Die S. des Handels enthält 60–70 Proz. S. oder 55–60 Proz. S., reine S. 30 Proz. S. Die reine S. des deutschen Arzneibuches hat das spez. Gew. 1,153 mit 25 Proz. HNO3, die rohe Säure das spez. Gew. 1,38–1,40 mit mindestens 61 Proz. HNO3 und die rauchende S. das spez. Gew. 1,486–1,50.
Aus dem bei Verkokung von Steinkohlen gewonnenen Ammoniak, auch aus Ammoniak, das aus Kalkstickstoff erhalten werden kann, wird S. dargestellt. indem man das Ammoniak mit Luftsauerstoff über Platinblech leitet, das an seiner Oberfläche eine gewisse Menge Platinschwamm enthält. Man erhält 85 Proz. der theoretischen S. in Gestalt einer ziemlich konzentrierten Säure. Bei Elektrolyse von geschmolzenem Alkalihydrat erhält man Alkalimetall und Stickstofftetroxyd und Sauerstoff; letztere Gase werden durch Wasser geleitet und liefern S. Um S. aus dem Stickstoff der Luft herzustellen, läßt man den Flammenbogen eines mäßig hoch gespannten Wechselstroms (von 5000 Volt) in einem magnetischen Feld sich bilden. Er wird dann zerpeitscht und nimmt die Form einer Scheibe an, die eine besonders starke Oxydation des Luftstickstoffs verursacht. In den Öfen von Birkeland und Eyde in Norwegen arbeitet man bei einem Energieverbrauch von ca. 500 Kilowatt mit Flammenscheiben von 2 m Durchmesser. Die daraus entweichende Luft enthält 2 Proz. Stickstoffoxyd, sie wird abgekühlt und in mit säurefesten Steinen ausgekleidete Türme geleitet, in denen das Stickstoffoxyd sich zu Tetroxyd oxydiert. Dies bringt man in Absorptionsräumen aus Granitplatten mit Wasser in Berührung, wobei sich S. bildet.
Rote rauchende S. ist konzentrierte S. mit hohem Gehalt an Stickstofftetroxyd. Man erhält sie durch Destillation von 2 Molekülen Kalisalpeter mit 1 Molekül oder weniger Schwefelsäure und Anwendung höherer Temperatur, bei der S. in Stickstofftetroxyd, Sauerstoff und Wasser zersetzt wird. Auch destilliert man Salpeter mit Schwefelsäure und setzt etwas Stärkemehl zu, um die Reduktion der S. zu befördern. Rauchende S. stößt an der Luft dichte rotbraune Dämpfe aus und hat das spez. Gew. 1,55; sie wirkt höchst ätzend, entzündet Phosphorwasserstoff, Jodwasserstoff, Stroh, Sägespäne etc., wird beim Verdünnen mit Wasser grün, dann blau, zuletzt farblos und entwickelt beim Erwärmen Stickstofftetroxyd.
S. ist nächst Schwefelsäure die stärkste Mineralsäure, sie wirkt sehr kräftig oxydierend und löst alle Metalle bis auf Gold und Platin unter Bildung von Nitraten (Blei, Eisen, Silber werden von sehr starker S. nicht angegriffen). Sie heißt Scheidewasser, weil sie aus einer Goldsilberlegierung Silber löst, Gold aber nicht. Auf organische Stoffe wirkt S. höchst energisch, oft unter Bildung von Oxalsäure und Kohlensäure. Auf manche Verbindungen wirkt starke S. substituierend, indem an die Stelle von 1 Atom Wasserstoff die Atomgruppe NO2 tritt. Diese Substitutionsprodukte heißen Nitroverbindungen. S. entfärbt Indigolöfung, färbt Haut, Nägel, Wolle gelb, greift alle tierischen Stoffe an und verändert sie, wirkt daher auch stark giftig. Mit Salzsäure bildet sie das Königswasser und mit Basen nur eine Reihe von Salzen. Nitrate gehen aus dem Boden in die Pflanzen über, sie sind, besonders salpetersaurer Kalk, unter natürlichen Verhältnissen das allgemeinste stickstoffhaltige Nahrungsmittel der Pflanzen.
Die S. dient häufig als Oxydationsmittel zur Darstellung von Schwefelsäure, Phosphorsäure, Jodsäure, vieler Metallpräparate, wie Eisenbeize (Rouille), Quecksilber- und Silbernitrat, Arsensäure, Knallquecksilber, Königswasser etc., zum Scheiden des Goldes vom Silber, zum Ätzen von Kupfer und Stahl, zum Gelbbrennen von Bronze und Messing, zum Brünieren des Eisens, zum Färben des Goldes, zur Darstellung von Nitrobenzol, Nitrotoluol, Nitronaphthalin, Nitroglyzerin, Schießbaumwolle, Pikrinsäure, Martiusgelb, Phthalsäure, Anthrachinon, Oxalsäure, Dextrin, zum Gelbfärben der Seide, zum Erzeugen gelber Muster auf blauem Grund in der Kattundruckerei, zum Gelbbeizen der Salleisten in der Tuchweberei etc.; in der Medizin dient rauchende S. als Ätzmittel bei Warzen, Feigwarzen, Noma und phagedänischen Geschwüren, verdünnte S. bei schlecht eitern den Wunden, Frostbeulen, Hautkrankheiten etc. S. war vielleicht schon den alten Ägyptern bekannt. Geber erhielt sie durch Erhitzen von Kupfervitriol mit Alaun und Salpeter, die spätern Alchimisten benutzten sie besonders zum Scheiden von Gold und Silber (Albertus Magnus) und nannten sie daher Scheidewasser. Die Darstellung aus Salpeter und Schwefelsäure lehrte Joh. Rud. Glauber. Gay-Lussac gab 1816 die genaue Zusammensetzung der S. an. 1898 führten Schwarz und Valentiner die Destillation von S. im Vakuum in die Praxis ein, 1899 begannen Bradley und Lovejoy ihre Arbeiten über die Darstellung von S. aus dem Stickstoff der Luft, und bald darauf stellte Ostwald S. aus Ammoniak durch Katalyse dar.
http://www.zeno.org/Meyers-1905. 1905–1909.