- Kohlensaures Natron
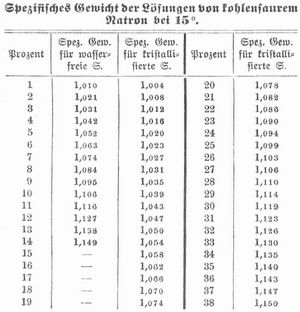
Kohlensaures Natron (Natriumkarbonat, Soda) Na2CO3 findet sich ausblühend auf vielen Gesteinen (Gneis, Traß, Tonlager vieler Steppen, z. B. das Szekso oder die Zickerde Ungarns, die Colpa Südamerikas), im Auswurf der Salsen und Schlammvulkane und gelöst in vielen Quellen in der Nähe plutonischer Gebirge (die Karlsbader Quellen liefern jährlich 6,6 Mill. kg). Derartige Quellen bilden in Niederungen Natronseen, aus denen sich im Sommer viel k. N. ausscheidet (westliches Unterägypten, Bornu, Fezzan, Kleinasien, Armenien, Persien, Hindostan, Tibet, Tatarei, Mongolei, China, Südamerika, Mexiko, Kalifornien). Das aus ägyptischen Seen gewonnene kohlensaure Natron (Sesquikarbonat) heißt Latruni; als Auswitterungsprodukt des Bodens liefert Ägypten die Trona, Südamerika Urao u. dgl. Während Landpflanzen beim Verbrennen eine Asche hinterlassen, die als Zersetzungsprodukt der Salze organischer Säuren kohlensaures Kali enthält, erhält man aus Strandpflanzen, die zum Teil zu diesem Zwecke kultiviert werden (Salsola, Salicornia, Atriplex, Chenopodium, Statice, Mesembryanthemum), eine an kohlensaurem Natron reiche Asche, aus der letzteres gewonnen wird (Barilla-, Alicante-Soda, Rocchetta, Salicor, Blanquette). Auch aus Kelp und Varech und aus Rübenmelasse wird k. N. (Soda) gewonnen, am meisten aber aus Kochsalz (Chlornatrium), das man nach dem Leblanc-Prozeß zunächst in schwefelsaures Natron verwandelt (wobei Salzsäure als Nebenprodukt auftritt), um dieses durch Schmelzen mit Kalk und Kohle in k. N. überzuführen. Nach dem Ammoniaksodaprozeß wird dagegen aus Kochsalzlösung durch doppeltkohlensaures Ammoniak doppeltkohlensaures Natron gefällt. Über die fabrikmäßige Darstellung s. Soda. Reines k. N. stellt man dar durch Umkristallisieren der käuflichen kristallisierten Soda aus der gleichen Gewichtsmenge destillierten Wassers von 30–40°, wobei man umrührt, um kleine Kristalle zu erhalten, die mit wenig kaltem Wasser oder mit einer Lösung von reinem Natriumkarbonat gewaschen werden müssen. Auch kann man gepulvertes Natriumbikarbonat mit wenig kaltem Wasser auswaschen und den Rückstand glühen. K. N. kristallisiert in großen, farblosen, wasserhellen, monoklinen Säulen mit 10 Molekülen Kristallwasser (62,9 Proz.) vom spez. Gew. 1,44 bei 16°, schmeckt und reagiert alkalisch, die Kristalle verwittern an der Luft und zerfallen zu einem kristallinischen Pulver mit 5 Molekülen Wasser, das bei 38° noch 4 Moleküle Wasser verliert (Natrium carbonicum siccum). Die Kristalle schmelzen bei 34° in ihrem Kristallwasser zu einer klaren Flüssigkeit, aus der sich bei fortgesetztem Erhitzen ein Salz mit 1 Molekül Wasser abscheidet. Bei 100° wird k. N. wasserfrei (spez. Gew. 2,5), nimmt dann aber an feuchter Luft allmählich wieder Wasser auf. Aus gesättigten Lösungen kristallisiert k. N. bei 30–50° in rhombischen Kristallen mit 7 Molekülen Wasser. 100 Teile Wasser lösen Teile Na2CO3+10H2O bei
Die Abnahme der Löslichkeit des kristallisierten Salzes über 38° beruht auf der Bildung eines an Kristallwasser ärmern, schwerer löslichen Salzes.
Das wasserfreie Salz schmilzt bei 818° und erstarrt kristallinisch; bei längerm Schmelzen verliert das Salz etwas Kohlensäure. Leichter schmilzt eine Mischung gleicher Moleküle von Natrium- und Kaliumkarbonat. Aus der konzentrierten Lösung solcher Mischung kristallisiert NaKCO3+6H2O. Schwefel bildet beim Schmelzen mit kohlensaurem Natron Schwefelnatrium und unterschwefligsaures Natron.
Zweifach- oder saures k. N. (Natriumbikarbonat) NaHCO3 findet sich gelöst in vielen kohlensäurereichen Mineralwässern (Bilin, Ems, Vichy) und entsteht beim Sättigen von kohlensaurem Natron mit Kohlensäure, tritt auch bei der Ammoniaksodafabrikation als Zwischenprodukt auf (vgl. Soda). Es bildet kleine monokline Tafeln, die meist zu Krusten vereinigt sind, spez. Gew. 2,22 bei 16°, schmeckt mild, schwach alkalisch, bläut rotes Lackmuspapier, verändert nicht Kurkumapapier, ist im kristallisierten Zustand luftbeständig, verwandelt sich aber als Pulver an der Luft allmählich in Natriumsesquikarbonat, das stärker alkalisch reagiert. 100 Teile Wasser lösen bei
Die Lösung verliert, besonders beim Schütteln, etwas Kohlensäure, und die Bildung von Sesquikarbonat wächst mit der Temperatur. Über 70° wird das Salz vollständig zersetzt. Auch bei schnellem Verdampfen der Lösung scheidet sich Sesquikarbonat Na2CO3.2NaHCO3+3H2O in monoklinen Säulen ab. Über die Benutzung der Karbonate s. Soda.
http://www.zeno.org/Meyers-1905. 1905–1909.