- Essigsäure
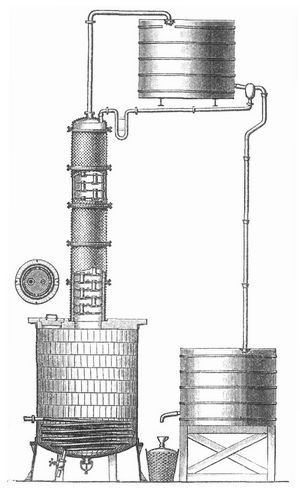
Essigsäure (Äthansäure, Acetylsäure) CH3.COOH oder C2H4O2 findet sich in der Natur teils frei, teils in Form von Salzen oder Estern im Pflanzenreich, im Schweiß und Muskelsaft, im Safte der Milz und andrer Drüsen, im Blut Leukämischer und nach reichlichem Genuß von Kohlehydraten auch im Magen. Sie entsteht aus Natriummethyl und Kohlensäure, aus Natriummethylat und Kohlenoxyd, bei der trocknen Destillation der meisten nicht flüchtigen organischen Körper, wie Holz (daher im Holzessig), beim Schmelzen von Zucker, Weinsäure und ähnlichen Substanzen mit Kalihydrat, bei der Fäulnis und hauptsächlich bei der Oxydation des Alkohols. Reiner Alkohol verdunstet an der Luft unverändert, läßt man ihn aber auf sein verteiltes Platin (Platinmohr) tröpfeln, so wird er schnell zu E. oxydiert: CH3.CH2OH + O2 = CH3.COOH + H2O. Platinmohr enthält verdichteten Sauerstoff, und dieser wird auf den Alkohol übertragen. Verdünnter Alkohol geht bei Gegenwart des Essigferments an der Luft gleichfalls in E. über, und darauf beruht die Essiggewinnung. Konzentrierte E. wird meist aus Holzessig dargestellt. Dieser enthält 10 Proz. E. und 1 Proz. Methylalkohol. Man erhitzt ihn in einer Blase, leitet die Dämpfe in Kalkmilch, reinigt die Kalklauge von überschüssigem Kalk und Teer auf der Filterpresse, säuert zur Abscheidung von Teer mit Salzsäure an, verdampft und erhitzt den Rückstand zur Zerstörung von Teer. Dieser graue Holzkalk (Weißkalk) mit 80–82 Proz. essigsaurem Kalk enthält noch Teerreste, Ameisensäure, Propionsäure und Buttersäure, er wird in einer flachen Blase durch konzentrierte Schwefelsäure zersetzt und die entweichende rohe E. in einer Tonschlange verdichtet. Die rohe Säure wird mit etwas Acetat in einer Blase mehrere Stunden bis nahe zum Siedepunkt der E. erhitzt, um die Verunreinigungen zu verflüchtigen, dann bei 50° mit Chromsäuregemisch oder übermangansaurem Kali behandelt, um schweflige Säure in Schwefelsäure zu verwandeln und Ameisensäure und empyreumatische Stoffe zu zerstören. Zur Rektifikation der E. benutzt man Kolonnenapparate wie bei der Spiritusfabrikation. Sie bestehen aus Kupfer mit einem Eingeweide aus Porzellan, oder sie sind ganz aus Ton gefertigt. Letztere besitzen eine eiserne, durch eine Dampfschlange heizbare Blase, die mit Tonplatten und einem essigsäurefesten Kitt ausgemauert ist (s. Abbildung). Die Kolonne enthält siebartig durchlochte Tonplatten mit Übersteigzylindern, oder sie ist mit sogen. Kegeln aus Ton gefüllt, die das Prinzip der Dephlegmation in bester Weise zur Durchführung gelangen lassen. Zum Schutz der Arbeiter bei etwaigem Springen der Tonwandung wird diese mit einem engmaschigen Kupferdrahtnetz oder mit einer Ummantelung umgeben.
Letztere besteht aus einem nicht dicht anschließenden Metallmantel und einer unter Druck eingeführten Homogenmasse, die, sobald ein Riß entstehen sollte, sich so fest an die Tonwände anlegt, daß Gase oder Flüssigkeiten nicht hindurchdringen können. Bei der Rektifikation der Rohsäure mit ca. 70 Proz. E. erhält man zunächst eine Fraktion, die alle in der Rohsäure noch vorhanden gewesenen fremden Säuren enthält und für technische Zwecke in den Handel kommt. Die dann folgenden Fraktionen sind völlig rein, müssen aber zur Verwendung für Speiseessig oder zu Arzneizwecken einer nochmaligen einfachen Destillation mit Thermometer in den Feinsäureapparaten unter Abtrennung geringer Mengen Vor- und Nachlauf unterworfen werden. Die auf dem Kolonnenapparat erhaltenen reinsten und stärksten Anteile liefern nach der oftmals unter Zusatz von konzentrierter Schwefelsäure ausgeführten ein- oder zweimaligen Destillation im Feinsäureapparat Eisessig von 95–100 Proz. Höchst konzentrierte Säure kann man auch dadurch gewinnen, daß man bei genügender Abkühlung einige Essigsäurekristalle in die Säure wirft und nach vollendeter Kristallisation die flüssig gebliebene Säure abgießt.
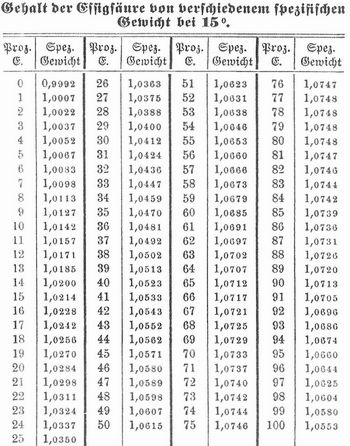
E. bildet eine farblose Flüssigkeit, riecht und schmeckt stechend sauer, wirkt höchst ätzend, erzeugt auf der Haut schmerzhafte Brandblasen, zieht an der Luft begierig Feuchtigkeit an, raucht in ammoniakalischer Luft, erstarrt bei 16,7° blätterig-kristallinisch (Eisessig, Acetum glaciale), siedet bei 118°, ist brennbar, mischt sich mit Wasser, Alkohol und Äther, löst einige ätherische Ole (E. von 99 Proz. löst Zitronenöl in allen Verhältnissen, E. von 95–96 Proz. im Verhältnis von 1:10, Kampfer, Harze, fette Öle, Farbstoffe) und reagiert stark sauer. Das spezifische Gewicht der reinen E. ist 1,055 bei 15°, es steigt bei Zusatz von Wasser auf 1,0748, wobei die Säure dem Hydrat C2H4O2 + H2O entspricht, und sinkt dann wieder, so daß eine E., die 43 Proz. reine E. enthält, wieder das spezifische Gewicht 1,055 zeigt (vgl. Tabelle).
Das Acidum aceticum des deutschen Arzneibuches besitzt das spezifische Gewicht von höchstens 1,064, siedet bei 117–118° und enthält 96 Proz. E. Das Acid. acet. dilutum (Acetum concentratum) vom spez. Gew. 1,041 enthält 30 Proz. E. E. wirkt gärungswidrig; stark verdünnt, schimmelt sie an der Luft und zerfällt in Kohlensäure und Wasser. Kaliumacetat liefert bei Elektrolyse Äthan, Natriumacetat liefert beim Erhitzen mit Natronkalk Methan, Kaliumacetat bildet beim Erhitzen mit arseniger Säure Kakodyloxyd, Ammoniumacetat verwandelt sich beim Erhitzen in Acetamid, Calciumacetat liefert Aceton und beim Erhitzen mit Calciumformiat Aldehyd. Bei Einwirkung von Chlor auf E. im Sonnenlicht entstehen drei Chloressigsäuren, von denen die Trichloressigsäure C2HCl3O2 schwach stechend riecht, in Wasser, Alkohol und Äther löslich ist, bei 55° schmilzt, bei 195° siedet und beim Erwärmen mit überschüssigem kohlensaurem Natron Chloroform bildet. Sie entsteht auch bei Behandlung von Chloral mit Salpetersäure.
E. bildet mit 1 Äquivalent der Basen leicht lösliche kristallinische Salze (Acetate), mit Eisen, Aluminium, Blei und Kupfer bildet sie auch schwer lösliche basische Salze, und die Acetate der Alkalimetalle verbinden sich mit noch einem Molekül E. zu sauren Salzen. Verdünnte E. (Essig) wirkt durstlöschend, kühlend, setzt, in größern Quantitäten genommen, die Pulsfrequenz und Körpertemperatur herab, veranlaßt bei längerm Gebrauch Verdauungsstörungen, Appetitlosigkeit, Neigung zum Durchfall, Kolikschmerzen; das Gesicht wird blaß, es erfolgt Abmagerung und bisweilen Lungenschwindsucht. Reine E. wirkt innerlich ätzend wie Mineralsäure; äußerlich dient sie als blasenziehendes Mittel (vesicatoire de Beauvoisin), als Ätzmittel bei Warzen und Hühneraugen (Acetine ist mit 0,5 Volumen Wasser verdünnte E.) und zu Riechfläschchen. Verdünnte E. (Essig) wird auch als blutstillendes Mittel, zu Waschungen bei starken Schweißen, zu Umschlägen bei Kontusionen etc. benutzt. Außerdem dient E. in der Färberei und Kattundruckerei, in der Photographie, zur Darstellung von Anilin, vielen Salzen und Äthern. Ein Gehalt der E. an empyreumatischen Stoffen tritt deutlich hervor, wenn man die E. verdünnt, neutralisiert und erwärmt.
Geschichtliches. Essig, aus sauer gewordenen Fruchtsäften, Wein und Bier erhalten, war bereits im Altertum bekannt und als kühlendes Getränk geschätzt. Man wußte auch, daß er gewisse Steine und Metalle löst, auf manchen Steinen Aufbrausen erzeugt etc. Die Alchimisten arbeiteten viel mit Essig. Geber reinigte ihn im 8. Jahrh. durch Destillation, und Basilius Valentinus erhielt im 15. Jahrh. durch fraktionierte Destillation und durch trockne Destillation des Grünspans stärkere E. Stahl ließ 1723 Essig gefrieren, beseitigte das Eis und gewann auf diese Weise ebenfalls stärkern Essig. Er stellte auch E. durch Destillation von essigsaurem Kali mit Schwefelsäure dar, und Lowitz entdeckte 1789 die reine kristallisierte E. Glauber bezeichnete 1658 die durch trockne Destillation des Holzes erhaltene Säure als E. Später wurde die Identität geleugnet, bis sie von Fourcroy und Vauquelin nachgewiesen wurde. Daß die Essigbildung auf einer Oxydation beruhe, hatte schon Lavoisier erkannt; doch ward der Prozeß erst später genauer untersucht. Berzelius stellte 1814 die Zusammensetzung der E. fest, und Liebig zeigte den Unterschied zwischen Alkohol- und Essiggärung. Das Prinzip der Schnellessigfabrikation ward von Boerhaave 1732 angegeben, für die Technik aber 1823 durch Schützenbach zu Eudingen im Breisgau und durch Wagenmann in Berlin (1825) nutzbar gemacht. Die ersten größern Holzverkohlungsöfen wurden 1819 zu Hausach in Baden in Betrieb gesetzt, und in neuester Zeit gestalteten sich für die Darstellung der E. aus Holz die Verhältnisse günstiger, als der 1812 im Holzessig nachgewiesene Methylalkohol für die Teerfarbenindustrie große Bedeutung gewann. Vgl. Klar, Technologie der Holzverkohlung und der Fabrikation von E. etc. (Berl. 1903).
http://www.zeno.org/Meyers-1905. 1905–1909.