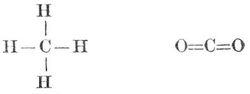- Kohlenstoff
Kohlenstoff (Carboneum) C, chemisch einfacher Körper, tritt in drei Modifikationen auf: tesseral kristallisiert als Diamant, monoklinisch kristallisiert als Graphit und amorph als Kohle. Die erste Modifikation findet sich nur als Diamant, kann aber auch künstlich dargestellt werden. Graphitartiger K. findet sich als Graphit, auch im Roheisen, in Blasenräumen der Eisenschlacken, in Höhlen der Gestellsteine, der Hochöfen; auch entsteht er bei Zersetzung der Cyanverbindungen. Amorpher K. scheidet sich mehr oder weniger rein beim Erhitzen organischer Verbindungen unter Abschluß der Luft aus und bildet die Kohle, die meist noch Wasserstoff und Sauerstoff, oft auch Stickstoff und mineralische Stoffe enthält. Hierher gehören Koks, Gaskohle (Retortengraphit), Ruß, Holzkohle, Knochenkohle etc. Sehr reinen amorphen K. erhält man beim Verkohlen aschefreier organischer Substanzen, wie Zucker, und beim Erhitzen kohlenstoffreicher Kohlenwasserstoffe, die in K. und kohlenstoffärmere Kohlenwasserstoffe zerfallen. Der K. ist in allen drei Modifikationen geruch- und geschmacklos, das spezifische Gewicht des Diamanten ist 3,5, das des Graphits 2,1–2,3. Er ist in den gewöhnlichen Lösungsmitteln unlöslich, löst sich aber in geschmolzenem Eisen, ist unschmelzbar, in hohem Grade feuerbeständig, verflüchtigt sich aber im elektrischen Ofen bei einem Strom von 1200 Ampere und 80 Volt, auch im Vakuum der Glühlampen (bei etwa 1200–1500°), deren innere Wandung er mit einem braunen Überzug bekleidet, er ist bei gewöhnlicher Temperatur völlig indifferent und an der Luft unveränderlich, während er, an der Luft erhitzt, zu Kohlensäure verbrennt, am schwersten der Diamant, am leichtesten der amorphe K. Auch durch Oxydationsmittel kann der K. zu Kohlensäure oxydiert werden, mit Übermangansäure gibt er Mellithsäure und Oxalsäure; er verbindet sich in hoher Temperatur mit Schwefel zu Schwefelkohlenstoff, mit Stickstoff aber nur, wenn ein Körper zugegen ist, mit dem sich das entstehende Cyan vereinigen kann. Mit einigen Metallen bildet K. direkt Karbide (Karburete). Vielen Sauerstoffverbindungen entzieht der K. Sauerstoff; er reduziert z. B. Metalloxyde, gibt mit Schwefelsäure schweflige Säure, mit Phosphorsäure Phosphor etc. Die spezifische Wärme aller drei Formen des Kohlenstoffs ist sehr gering, was auf ein hohes Molekulargewicht hindeutet, wie denn auch Graphit und amorphe Kohle bei der Oxydation hochmolekulare Verbindungen mit Wasserstoff und Sauerstoff liefern. Das Atomgewicht des Kohlenstoffs ist 12, er ist vierwertig und seine Oxydationsstufen sind Kohlenoxyd CO und Kohlensäure CO2. K. bildet zahlreiche chemische Verbindungen, und weil viele von ihnen Bestandteile der Pflanzen und Tiere sind, so nennt man die Kohlenstoffverbindungen auch organische Verbindungen und die Lehre von denselben organische Chemie im Gegensatz zur anorganischen. Man kennt indes gegenwärtig sehr viel mehr künstlich dargestellte als in der Natur vorkommende Kohlenstoffverbindungen. Die Mannigfaltigkeit der letztern beruht auf den Eigenschaften des vierwertigen Kohlenstoffatoms, das 4 Atome eines einwertigen oder 2 Atome eines zweiwertigen Elements zu binden vermag:
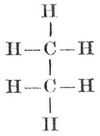
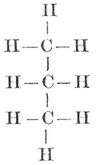
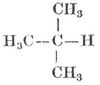
Die vier Affinitätseinheiten des Kohlenstoffatoms sind gleichwertig, die vier Wasserstoffatome des Methans CH4 sind völlig gleichartig gebunden, und bei der Substitution eines dieser Atome durch ein andres einwertiges Element entsteht stets dieselbe Verbindung. Kohlenstoffatome können sich miteinander verketten und zwar mit je einer ≡C-C≡, mit je zwei =C=C= oder mit je drei Valenzen -C≡C-. Im ersten Falle (einfache oder einwertige Bindung) hat die Atomgruppe noch sechs, im zweiten (zweifache oder Doppelbildung, zweiwertige Bindung) noch vier, im dritten (dreifache oder dreiwertige Bindung) noch zwei freie Valenzen zur Verfügung. Die Verbindungen der Kohlenstoffatome sind die Kohlenstoffkerne (Kohlenstoffskelette), die entweder offene Kohlenstoffketten oder geschlossene Ketten (Kohlenstoffringe) bilden. Die Kohlenstoffkerne vermögen mit den übrigbleibenden, nicht zur Kernbildung verwendeten Valenzen die Atome andrer Elemente oder Atomgruppen der verschiedensten Art zu binden, und auf diese Weise entstehen die zahllosen Kohlenstoffverbindungen.
Je nachdem die Kohlenstoffatome in den Molekülen nur mit 1 andern, mit 2, 3 oder 4 Kohlenstoffatomen verbunden sind, nennt man sie primär gebundene oder primäre, sekundär gebundene oder sekundäre etc.
Nach der Art der chemischen Verkettung der Kohlenstoffatome und des durch dieselbe bedingten Gesamtcharakters der Verbindungen teilt man diese in zwei Klassen: die Fettkörper (aliphatische Substanzen, Methanderivate) und in die karbo- oder isozyklischen Verbindungen. Die Methanderivate enthalten offene Ketten, z. B. CH3.CH2.CH2.CH2.CH3, die karbozyklischen geschlossene. Von letztern, den Kohlenstoffringen, beansprucht der aus 6 Kohlenstoffatomen bestehende Benzolring (s. Kohlenwasserstoffe, S. 243) mit sechs freien Valenzen eine besondere Bedeutung. Von ihm leiten sich die aromatischen Körper ab, die man den aliphatischen als zweite Klasse der Kohlenstoffverbindungen gegenüberstellte, bis man immer zahlreichere Substanzen auffand, die zwar ringförmig verbundene Kohlenstoffatome enthielten, aber im chemischen Charakter den Fettkörpern näher stehen als den aromatischen Verbindungen. Schon die sogen. hydroaromatischen Verbindungen nähern sich um so mehr den Fettkörpern, je mehr Wasserstoffatompaare sich in ihnen mit dem Benzolkern einer aromatischen Verbindung vereinigt haben; noch näher stehen den Fettkörpern die Substanzen, die einen aus 3, 4 oder 5 Kohlenstoffatomen bestehenden Ring enthalten, die Tri-, Tetra- und Pentamethylenderivate. Sie bilden den Übergang von den Fettkörpern zu den hydroaromatischen Verbindungen, an die sich die aromatischen Substanzen anschließen. Viele Kohlenstoffverbindungen enthalten Ringe, an deren Bildung außer den Kohlenstoffatomen auch Sauerstoff-, Schwefel- oder Stickstoffatome beteiligt sind. In diesen heterozyklischen Verbindungen zeigt der Ring oft eine ebenso große Beständigkeit wie der Benzolring.
Der reine K. spielt in der Natur nur eine untergeordnete Rolle, dagegen sind seine Verbindungen die Grundlage alles organischen Lebens. Alle Pflanzen und Tiere bestehen aus Verbindungen des Kohlenstoffs mit Sauerstoff, Wasserstoff und Stickstoff, während ihr Gehalt an mineralischen Substanzen untergeordnet ist (ein Mensch von 70 kg Gewicht enthält im Durchschnitt 12 kg Kohlenstoff neben 44 kg Sauerstoff und 6 kg Wasserstoff). Gehen die Organismen zugrunde, so werden ihre Bestandteile in der Regel durch Fäulnis- und Verwesungsprozesse zersetzt, und es entstehen einfachste Verbindungen: Kohlensäure, Wasser und Ammoniak. Diese Verbindungen sind aber neben gewissen mineralischen Stoffen die Nahrungsmittel der Pflanzen, die in den chlorophyllhaltigen Zellen unter dem Einfluß des Lichtes alle organische Substanz aus Kohlensäure und Wasser bilden. Die Pflanzensubstanz gelangt zum Teil als Nahrung in den tierischen Organismus und wird hier mannigfach modifiziert, in Blut und Fleisch verwandelt, schließlich durch den Atmungsprozeß und durch die Fäulnis der Exkremente wieder in Kohlensäure und Wasser verwandelt. Große Mengen K. entziehen sich zeitweise diesem Kreislauf, indem sie als fossile Kohle abgelagert oder als Kohlensäure an Kalk gebunden werden (Kalkstein, Marmor, Kreide). Aber auch die fossile Kohle wird schließlich wieder oxydiert (in Kohlensäure verwandelt), und die Kohlensäure des Kalksteins wird in Freiheit gesetzt, wenn der letztere unter der Einwirkung von Kieselsäure sich in Kieselgestein verwandelt. Diamant galt lange Zeit für eine reine Art Bergkristall, Averami und Targioni zeigten aber seine Verbrennlichkeit im Brennpunkt eines kräftigen Brennspiegels, und Lavoisier wies 1773 die Bildung von Kohlensäure bei der Verbrennung des Diamanten nach. Mackenzie fand 1800, daß Diamant ebensoviel Kohlensäure gibt wie dasselbe Gewicht Kohle oder Graphit, welch letzterer früher mit Molybdänglanz verwechselt wurde, bis Scheele 1779 seine wahre Natur erkannte. Die künstliche Darstellung des Diamanten gelang zuerst 1880 Ballantyne Hannay in Glasgow. Vgl. Baeyer, Über den Kreislauf des Kohlenstoffs (2. Aufl., Berl. 1869).
http://www.zeno.org/Meyers-1905. 1905–1909.