- Kieselfluorid
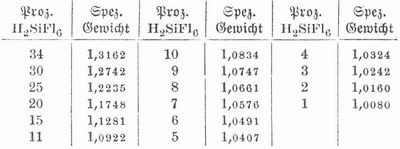
Kieselfluorid (Siliciumtetrafluorid, Fluorkiesel, Fluorsilicium) SiFl4 entsteht beim Erwärmen von Flußspat (Fluorcalcium) und Quarzsand (Kieselsäureanhydrid) mit konzentrierter Schwefelsäure, ist ein farbloses Gas vom spez. Gew. 3,6, riecht und schmeckt stechend sauer, bildet an feuchter Luft dichte Nebel, wird unter einem Druck von 30 Atmosphären zu einer farblosen Flüssigkeit verdichtet, erstarrt bei -102°, greift Glas nicht an, erträgt hohe Temperaturen und zerfällt mit Wasser in gallertartig sich ausscheidende Kieselsäure und Kieselfluorwasserstoffsäure oder Kieselflußsäure H2SiFl6. Zur Darstellung der Kieselfluorwasserstoffsäure leitet man K. in Wasser und läßt dabei die Mündung des Gasrohrs, damit es sich durch die ausgeschiedene Kieselsäure nicht verstopfe, in Quecksilber tauchen; ist die Flüssigkeit breiig geworden, so preßt man die Kieselsäure ab, leitet in die Lösung von neuem K. und fährt so bis zur gewünschten Konzentration fort. Beim Großbetrieb erhitzt man ein Gemenge von Flußspat, Sand und Kohle im Schachtofen und läßt das K. in einen mit Ziegeln lose ausgesetzten Turm strömen, in dem Wasser herabrieselt. Auch zersetzt man ein erhitztes grobkörniges Gemenge von Flußspat und Sandstein durch austropfendes Wasser und verdichtet die Dämpfe (wobei keine Kieselsäure ausgeschieden wird). Auch wird die Säure als Nebenprodukt bei der Darstellung von Superphosphat gewonnen. Sie bildet eine farb- und geruchlose Flüssigkeit, die an der Luft raucht, sehr sauer schmeckt und sauer reagiert, Glas nicht angreift, bei einer bestimmten Konzentration aber und beim Erwärmen in K. und Fluorwasserstoffsäure zerfällt und dann auch Glas ätzt. Mit der bei ihrer Darstellung ausgeschiedenen Kieselsäure verdampft, zersetzt sie sich rückwärts zu K. Leitet man Chlorwasserstoff in die durch Zersetzung von K. mit Wasser erhaltene Mischung, so verschwindet die Kieselsäure, es entweicht K., und Salzsäure bleibt zurück. Kieselfluorwasserstoffsäure wirkt gärunghemmend. Der Gehalt der Säure bei verschiedenem spezifischen Gewicht beträgt:
Mit Basen bildet Kieselfluorwasserstoffsäure Salze (Kieselfluormetalle, Silikofluoride), die meist in Wasser löslich und kristallisierbar sind. Beim Erhitzen geben sie Fluorsilicium, und als Rückstand bleibt Fluormetall. Die Verbindungen des Kaliums, Natriums, Lithiums, Baryums und Calciums sind gallertartig und schwer löslich. Kieselfluornatrium Na2Si Fl6 scheidet sich beim Versetzen von gesättigter Chlornatriumlösung mit Kieselfluorwasserstoffsäure zunächst gallertartig aus, wird aber allmählich kristallinisch; es wurde als antiseptisches Mittel empfohlen. Andre Salze, besonders die von Magnesium, Zink, Aluminium, Blei, dienen nach Keßler (Keßlersche Fluate) als Härtungs- und Konservierungsmittel für Baumaterialien, speziell für weiche Kalk- und Sandsteine, für Luftmörtel, Zement, Gips, Terrakotta. Salze von Eisen, Kupfer, Chrom benutzt man zum Färben der Steine (vgl. »Fluates-Kessler«, 6. Aufl., Par. 1891; deutsch von Hauenschild, 2. Aufl., Berl. 1895). Man benutzt Kieselfluorwasserstoffsäure zur Abscheidung mancher Säuren aus ihren Kalisalzen, zur Darstellung von chlorsaurem Natron, auch als Surrogat der Weinsäure in der Färberei und Druckerei; sie eignet sich ferner zur Herstellung künstlicher Steine, zur Fixation der Farben in der Stereochromie, zum Weißsieden von Stecknadeln, zur Sodafabrikation direkt aus Kochsalz und zur Pottaschegewinnung aus Chlorkalium, zum Aufschließen der Knochen und Phosphorite etc. Diese Verwendbarkeit der Kieselfluorwasserstoffsäure ist um so beachtenswerter, als man die bei ihrer Darstellung sich abscheidende Kieselsäure zur Bereitung von Wasserglas, Zement, alaunfestem Ultramarin, zur Entkalkung des Rübensaftes und zum Aufschließen des Kryoliths benutzen kann.
http://www.zeno.org/Meyers-1905. 1905–1909.