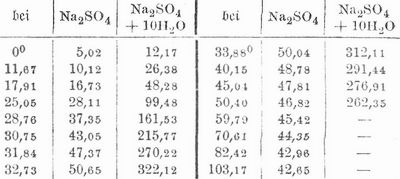- Schwefelsaures Natron
Schwefelsaures Natron (Natriumsulfat) Na2SO4 findet sich als Thenardit und Mirabilit, gelöst in Steppenseen Amerikas und Asiens, in den meisten Solen, namentlich auch in den Bitterwässern (Friedrichshall) und im Meerwasser, als Ausscheidung in vielen Binnenseen der aralo-kaspischen Senke, 2 m mächtig in der Adschidarjabucht an der Ostküste des Kaspischen Meeres; mit Gips, Kochsalz und Bittersalz bildet es Gebirgsmassen im Ebrotal; mit schwefelsaurem Kalk findet es sich als Glauberit und Brogniartin und mit schwefelsaurer Magnesia als Löweït. Es wird in großen Mengen für die Sodafabrikation nach dem Leblancschen Prozeß als Sulfat dargestellt, indem man Kochsalz (Chlornatrium) mit Schwefelsäure oder mit Schwefliger Säure, Wasserdampf und Luft behandelt. Als Nebenprodukt erhält man es bei Darstellung von Salpetersäure aus salpetersaurem Natron und Schwefelsäure, von Salzsäure aus Kochsalz und Schwefelsäure, bei Sublimation von schwefelsaurem Ammoniak mit Kochsalz, bei der Ultramarinfabrikation etc.; bei Verarbeitung des Teers auf Paraffin und Leuchtöle werden große Mengen Natronlauge und Schwefelsäure als Reinigungsmittel verbraucht, die man schließlich auf s. N. verarbeiten kann. Aus einer Lösung von schwefelsaurer Magnesia und Kochsalz kristallisiert bei sehr niedriger Temperatur (im Winter oder unter Anwendung einer Eismaschine) s. N., und in dieser Weise stellt man das Salz aus Mutterlaugen der Salinen und der Staßfurter Abraumsalze dar. Man läßt das Salz entweder kristallisieren oder verdampft die Losung, fischt das ausgeschiedene Salz aus und kalziniert es (kalziniertes Glaubersalz). Beim Rösten kupfer-, blei- und silberhaltiger Schwefelkiese mit Kochsalz entweicht Chlor und entsteht s. N., das durch Wasser ausgezogen werden kann. S. N. kristallisiert wasserfrei, mit 1, 7 oder 10 Molekülen Kristallwasser, die letztern Kristalle, welche 55,9 Proz. Wasser enthalten, bilden das Glaubersalz des Handels. Diese haben das spez. Gew. 1,46, schmecken kühlend salzig-bitter und lösen sich leicht und unter starker Temperaturerniedrigung in Wasser, nicht in Alkohol. 100 Teile Wasser lösen:
Glaubersalz verwittert an der Luft und schmilzt bei 33° im Kristallwasser. Bei höherer Temperatur wird es wasserfrei, schmilzt dann bei 843° und verdampft bei Weißglut. Man benutzt es zu Kältemischungen, zur Darstellung von Soda, Ultramarin, Glas, Wasserglas, Natriumaluminat, Antimon, zur Umsetzung von essigsaurem, unterchlorigsaurem und unterschwefligsaurem Kalk in Natronsalz, in der Färberei und als Abführmittel. Wasserfreies s. N. mit Kaliumsulfat zusammengeschmolzen gibt eine glasige amorphe Masse, aus deren Lösung in heißem Wasser beim Erkalten ein Doppelsalz unter lebhafter Lichtentwickelung kristallisiert. Saures schwefelsaures Natron (Natriumbisulfat) HNaSO4 wird als Nebenprodukt bei Darstellung von Salpetersäure erhalten. Es bildet über 50° farblose wasserfreie, bei niederer Temperatur Kristalle mit 1 Molekül Kristallwasser und verwandelt sich im Vakuum bei 300° in pyroschwefelsaures Natron (Natriumpyrosulfat) Na2S2O7, das bei stärkerm Erhitzen in s. N. und Schwefelsäureanhydrid zerfällt. Es dient als Ersatz des Weinsteins z. B. in der Färberei, mit chlormagnesiumhaltigem Abraumsalz gemischt, zur Entzinkung des Bleies nach dessen Entsilberung durch Zink und zur Darstellung rauchender Schwefelsäure. Glaubersalz wurde zuerst 1658 durch Glauber aus dem Rückstand von der Bereitung der Salzsäure gewonnen und als Sal mirabile Glauberi bekannt. 1767 wurde es aus Friedrichshaller Bitterwasser im großen dargestellt. Scheele zeigte 1785, daß Chlornatrium und Magnesiumsulfat sich bei Winterkälte umsetzen, und seit 1864 wird dies Verhalten in Staßfurt technisch verwertet. Große technische Bedeutung gewann s. N. seit der Entwickelung der Sodafabrikation und der Benutzung zur Darstellung von Glas.
http://www.zeno.org/Meyers-1905. 1905–1909.