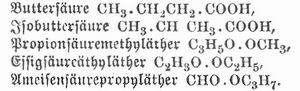- Isomerīe
Isomerīe (griech.), die Erscheinung, daß Körper von gleicher chemischer Zusammensetzung ungleiche Eigenschaften zeigen. Viele Elemente treten in verschiedenen Modifikationen (allotrope Zustände) auf. Gelber Phosphor und roter Phosphor zeigen im physikalischen Verhalten wie in der chemischen Reaktionsfähigkeit so große Verschiedenheiten, daß man glauben möchte, zwei stofflich verschiedene Körper vor sich zu haben. Kohlenstoff tritt als Diamant, Graphit und amorpher Kohlenstoff auf, Schwefel in rhombischer oder monosymmetrischer Kristallform. Worauf die Verschiedenheit der allotropen Modifikationen beruht, weiß man nicht, doch liegt die Annahme nahe, daß die Atome in verschiedener Anzahl oder in verschiedener Weise zu einem Molekül zusammengetreten sind. Viel häufiger zeigen chemische Verbindungen von gleicher prozentischer Zusammensetzung verschiedene Eigenschaften. Betreffen diese Verschiedenheiten nur die physikalischen Eigenschaften (kristallinischer oder amorpher Zustand, Kristallform, spezifisches Gewicht, Schmelzpunkt, Siedepunkt, optisches Verhalten etc.), so spricht man von physikalischer I. Quecksilberjodid tritt in einer gelben und einer scharlachroten Modifikation auf, schwefelsaures Chromoxydkali bildet eine grüne zerfließliche Masse und als Chromalaun violette Oktaeder etc. In andern Fällen und besonders bei Kohlenstoffverbindungen zeigen die isomeren Körper mehr oder minder große Verschiedenheiten im chemischen Verhalten. Solche chemische I. beruht nur bisweilen auf Verschiedenheit der Molekulargröße, indem die Atome zwar in gleichem Mengenverhältnis, aber in ungleicher Zahl zum Molekül der Verbindung sich vereinigt haben. Solche Körper nennt man polymer, wie Acetylen C2H2 und Benzol C6H6 oder Formaldehyd CH2O, Essigsäure C2H4O2, Milchsäure C3H6O3, Rhamnose C5H10O5, Rohrzucker C6H12O6 (I. im weitern Sinn). Bisweilen vereinigen sich mehrere Moleküle einer Verbindung zu einem polymeren Molekül, das unter andern Umständen wieder in die einfachern Moleküle gespalten wird, wie beim Acetaldehyd C2H4O und Paraldehyd C6H12O3, von denen ersterer flüssig ist und bei 21° siedet, letzterer kristallinisch ist und bei 124° siedet (genetische Polymerie). Am häufigsten ist die I. im engern Sinn, die eigentliche I., die auf einer verschiedenen Anordnung der Atome im Molekül, auf verschiedener Konstitution des Moleküls beruht (Metamerie). Man kennt z. B. fünf Körper, denen die empirische Formel C4H8O2 zukommt, die aber in ihren Eigenschaften wesentlich voneinander abweichen. Zwei von diesen Körpern sind Säuren, die übrigen sind zusammengesetzte Äther, und die I. erklärt sich also daraus, daß die Atome in den isomeren Molekülen verschieden gruppiert sind. Dies lassen die aus dem chemischen Verhalten der betreffenden Körper abgeleiteten rationellen Formeln erkennen:
Die Strukturisomerie umfaßt solche Fälle, bei denen die Verschiedenheit auf verschiedener Struktur, d. h. verschiedener Reihenfolge der gegenseitigen Bindung derselben und in gleicher Anzahl im Radikal vorhandenen Atome, beruht. Hier unterscheidet man Kern- oder Kettenisomerie mit verschiedener Bindungsfolge der den Kern des Radikals bildenden Kohlenstoffatome (z. B. Butan CH3.CH2.CH2.CH3 und Isobutan CH3.CH.+CH3)CH3) und Stellungs- oder Ortsisomerie, bei der an dem gleich gebildeten Kohlenstoffkern zwei oder mehr verschiedene Elemente verschiedenartig verteilt sind. Benzol hat die Formel C6H6 oder
 . Die 6 Wasserstoffatome sind gleichwertig, u. mithin entsteht, wenn 1 Atom Wasserstoff durch 1 Atom Chlor ersetzt wird, immer derselbe Körper C6H5Cl. Treten aber 2 Atome Chlor für 2 Atome Wasserstoff ein, so sind drei isomere Dichlorbenzole möglich: C6H4Cl2 (1.2, 1.3, 1.4); ebenso können sich 3 Trichlorbenzole C6H3Cl3 (1.2.3, 1.2.4, 1.3.5), 3 Tetrachlorbenzole C6H2Cl4 (1.2.3.4, 1.2.4.5, 1.3.4.5), aber nur ein Pentachlorbenzol C6HCl5 und ein Hexachlorbenzol C6Cl6 bilden. Diese zwölf von der Theorie vorgesehenen Chlorbenzole sind dargestellt worden. Statt des Chlors kann auch die Methylgruppe CH3 in das Benzol eintreten, und es entstehen dann Methylbenzole, Dimethylbenzole etc. In diese verschiedenen Körper kann fernerhin Chlor eintreten und zwar entweder an die Stelle von Wasserstoffatomen der Methylgruppen oder für Wasserstoffatome des Benzolkerns. Dadurch wird die Zahl der Isomerien sehr groß. Bei der geometrischen, räumlichen oder Stereoisomerie handelt es sich bei gleicher Struktur um verschiedene räumliche Anordnung der Atome oder Atomgruppen. So sind bei der Fumarsäure und der Maleïnsäure
. Die 6 Wasserstoffatome sind gleichwertig, u. mithin entsteht, wenn 1 Atom Wasserstoff durch 1 Atom Chlor ersetzt wird, immer derselbe Körper C6H5Cl. Treten aber 2 Atome Chlor für 2 Atome Wasserstoff ein, so sind drei isomere Dichlorbenzole möglich: C6H4Cl2 (1.2, 1.3, 1.4); ebenso können sich 3 Trichlorbenzole C6H3Cl3 (1.2.3, 1.2.4, 1.3.5), 3 Tetrachlorbenzole C6H2Cl4 (1.2.3.4, 1.2.4.5, 1.3.4.5), aber nur ein Pentachlorbenzol C6HCl5 und ein Hexachlorbenzol C6Cl6 bilden. Diese zwölf von der Theorie vorgesehenen Chlorbenzole sind dargestellt worden. Statt des Chlors kann auch die Methylgruppe CH3 in das Benzol eintreten, und es entstehen dann Methylbenzole, Dimethylbenzole etc. In diese verschiedenen Körper kann fernerhin Chlor eintreten und zwar entweder an die Stelle von Wasserstoffatomen der Methylgruppen oder für Wasserstoffatome des Benzolkerns. Dadurch wird die Zahl der Isomerien sehr groß. Bei der geometrischen, räumlichen oder Stereoisomerie handelt es sich bei gleicher Struktur um verschiedene räumliche Anordnung der Atome oder Atomgruppen. So sind bei der Fumarsäure und der Maleïnsäurean zwei zweiwertig miteinander verketteten Kohlenstoffatomen zwar dieselben und in gleicher Reihenfolge mit ihnen verbundenen Atome, aber in verschiedener räumlicher Ordnung angelagert enthalten. Enthält eine Verbindung ein asymmetrisches Kohlenstoffatom, so ist sie in zwei isomeren Modifikationen denkbar, von denen die eine das Spiegelbild der andern darstellt wie bei der Rechts- und Linksmilchsäure
Derartige Verbindungen drehen meist die Ebene des polarisierten Lichtes gleich stark, aber entgegengesetzt (optische I.), und wenn man gleiche Teile dieser Verbindungen mischt, so erhält man eine optisch inaktive polymere Verbindung.
Fumarsäure und Maleïnsäure besitzen verschiedene Verbrennungswärme, so daß man annehmen muß, daß die in Form von Atombewegung in den Säuren vorhandene Energie beträchtlich verschieden ist. Man braucht also den Grund der I. nicht ausschließlich in der verschiedenen Verkettung der Atome oder in ihrer verschiedenen räumlichen Anordnung zu suchen, sondern muß auch die Größe der Bewegung der Atome oder Atomkomplexe in Betracht ziehen. Ja, man kann annehmen, daß I. in gewissen Fällen nur durch diese Verschiedenheit des Energieinhalts bedingt ist bei völliger Gleichheit der Verkettung und sogar der räumlichen Anordnung der Atome (dynamische I., Energieisomerie, Alloergatie). 1823 fand Mitscherlich, daß kohlensaurer Kalk in zwei verschiedenen Kristallformen, als Aragonit und Kalkspat, auftreten kann, Liebig und Wöhler zeigten dann, daß Cyansäure und Knallsäure bei gleicher Zusammensetzung ganz verschiedene Eigenschaften besitzen. Berzelius hatte die verschiedenen Modifikationen der Zinnsäure entdeckt und fand 1830, daß Traubensäure und Weinsäure gleiche prozentische Zusammensetzung haben. Dies veranlaßte ihn zu der Ausstellung des Begriffs I., und etwas später unterschied er Meta merie und Polymerie, während er den Begriff Allotropie erst 1841 einführte. Vgl. Schaum, Die Arten der I. (Marb. 1897).
http://www.zeno.org/Meyers-1905. 1905–1909.