- Natriumhydroxyd
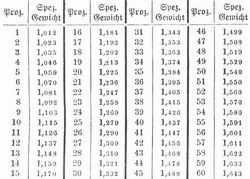
Natriumhydroxyd (Natriumoxydhydrat, Ätznatron, Natronhydrat) NaOH entsteht, wenn Natrium auf kohlensäurefreies Wasser oder gelöschter Kalk (Calciumhydroxyd) auf eine Lösung von kohlensaurem Natron einwirkt. Zur Darstellung löst man kristallisiertes kohlensaures Natron in 4 Teilen Wasser, erhitzt die Lösung im blanken eisernen Kessel zum Sieden, setzt allmählich frisch gelöschten Kalk hinzu und verfährt im übrigen wie bei der Bereitung des Kaliumhydroxyds (s. d.). Die so erhaltene Lösung von N. (Ätzlauge, Ätznatronlauge, Natronlauge) ist auch wie die Kalilauge zu behandeln. Die offizinelle Natronlauge enthält in 100 Teilen etwa 15 Teile N. und besitzt das spez. Gew. 1,168–1,172. Den Gehalt einer Natronlauge an N. bei verschiedenem spezifischen Gewicht zeigt folgende Tabelle, die für 15° gültig ist:
Durch Verdampfen der Natronlauge erhält man festes N.; doch wird dies gegenwärtig meist in den Sodafabriken im großen dargestellt und als kaustische Soda (Seifenstein, Sodastein) in den Handel gebracht (s. Soda). Man erhält N. auch bei der Verarbeitung des Kryoliths auf schwefelsaure Tonerde, durch Glühen von Natronsalpeter mit Braunstein oder metallischem Eisen, auch wird es elektrolytisch wie Kaliumhydroxyd (s. d.) dargestellt. Chemisch reines N. bereitet man mit Natrium, indem man dieses in einer silbernen Schale vorsichtig in Wasser einträgt. Das N. des Handels bildet eine weiße, steinartige Masse. Reines N. besteht aus 77,5 Proz. Natron und 22,5 Proz. Wasser, ist kristallinisch, durchscheinend, vom spez. Gew. 2,13, zerfließt an der Luft, erstarrt dann aber wieder unter Bildung von kohlensaurem Natron, löst sich leicht in Wasser und Alkohol und gleicht in seinen chemischen Eigenschaften im allgemeinen dem Kaliumhydroxyd. Es zerstört die meisten Pflanzen- und Tierstoffe und fühlt sich, weil es die Haut stark angreift, zwischen den Fingern schlüpfrig an. Es schmilzt unter Rotglut zu einer wasserhellen, farblosen Flüssigkeit und ist in höherer Temperatur flüchtig. Mit Säuren bildet es die Natronsalze, und aus Metallsalzen fällt es Metallhydroxyde. Man benutzt es in der Seifenfabrikation, zur Verarbeitung und Reinigung der Teeröle, des Erdöls etc., zur Darstellung von Natronwasserglas und Holzzellulose für die Papierfabrikation, künstlichem Alizarin und Resorzin, in der Bleicherei, zur technischen Wasserreinigung und überall in der chemischen Industrie, wo es auf die Wirkung einer starken Base ankommt. Die Fabrikation der festen kaustischen Soda mit Hilfe von Salpeter wurde 1844 von Weißenfeld in der Tennantschen Sodafabrik in Glasgow erfunden, doch beginnt die Entwickelung dieses Industriezweigs erst 1853 mit dem Patent von Gossage, der die schwefelnatriumhaltigen Laugen in einem Koksturm oxydierte. Die Industrie entwickelte sich fast vollständig in Lancashire. In Deutschland wird seit 1859 N. dargestellt.
http://www.zeno.org/Meyers-1905. 1905–1909.