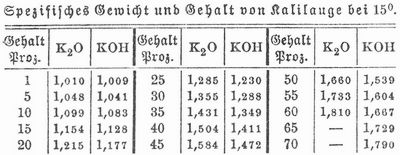
- Kaliumhydroxyd
Kaliumhydroxyd (Kaliumoxydhydrat, Kaliumhydrat, Ätzkali, Kalihydrat, Kali) KOH entsteht bei Einwirkung von kohlensäurefreiem Wasser auf Kalium oder von gelöschtem Kalk (Calciumhydroxyd) auf eine siedende Lösung von kohlensaurem Kali in 10–12 Teilen Wasser. Die Kohlensäure des Kalisalzes wird hierbei an den Kalk gebunden, man darf aber keine konzentriertere Lösung anwenden, weil eine starke Lösung von K. dem kohlensauren Kalk die Kohlensäure entzieht. Die von dem kohlensauren Kalk getrennte Lösung von K. bildet die Ätzlauge, Ätzkalilauge, Kalilauge. Eine unreine Lauge kann man aus Holzasche (die kohlensaures Kali enthält) darstellen, indem man die Asche mit Wasser auszieht und die Flüssigkeit mit gelöschtem Kalk kocht, oder indem man eine innige Mischung von Asche und gelöschtem Kalk mit Wasser auszieht. Bei der elektrolytischen Darstellung von K. aus Kaliumchloridlösung muß die Kathodenlösung von der Anodenlösung getrennt sein, so daß der Stromdurchgang zwar nicht gehindert, die Vermischung der Lösungen aber ausgeschlossen ist. Man benutzt zur Trennung eine poröse Scheidewand (Diaphragma) aus poröser Zementmasse, aus Ton etc., als Anode Kohle, als Kathode Eisen. Beim Quecksilberverfahren wird das Bad durch eine nicht poröse Scheidewand, die aber am Boden einen Durchlaß besitzt, in zwei Kammern geteilt, von denen die eine mit einer Kohlenscheibe als Anode die Chloridlösung, die andre mit einer Eisenscheibe als Kathode verdünnte Alkalilauge enthält. Über den Boden beider Kammern fließt beständig eine dünne Quecksilberschicht, welche die leitende Verbindung beider Räume herstellt und bei der Elektrolyse in der Anodenkammer Alkalimetall aufnimmt, das sie in der Kathodenkammer als K. an die Flüssigkeit abgibt, die nun abfließt, gehoben wird und auf der entgegengesetzten Seite wieder in den Anodenraum eintritt. Bei einem andern Verfahren benutzt man, weil sich die Konzentration der die beiderseitigen Elektroden umgebenden Flüssigkeit infolge des Stromdurchgangs erheblich ändert, lediglich diesen Unterschied im spezifischen Gewicht zur Trennung der Kathoden- und Anodenlauge (Glockenverfahren). Zur Darstellung von festem K. wird die klare Lauge in einem blanken gußeisernen Kessel über lebhaftem Feuer bis zum spez. Gew. 1,16, dann aber weiter in einem silbernen Gefäß eingedampft, weil die Lauge bei weiterer Konzentration Eisen oxydiert. Man bewahrt Kalilauge in Glasgefäßen auf und verschließt diese am besten mit Paraffinpfropfen, weil Kork und eingeriebene Glasstöpsel stark angegriffen werden.
Die Kalilauge des deutschen Arzneibuchs (Liquor Kali caustici) soll in 100 Teilen nahezu 15 Teile K. enthalten und das spez. Gew. 1,138–1,140 besitzen. Verdampft man die Ätzlauge weiter, so erstarrt sie beim Erkalten und bildet das trockne Ätzkali (Kali causticum siccum), das häufig in versilberten Formen in federkielstarke Zylinder gegossen wird (Ätzstein, geschmolzenes Ätzkali, Kali causticum fusum). Das aus kohlensaurem Kali dargestellte K. enthält die Verunreinigungen dieses Salzes. Zur Gewinnung von chemisch reinem K. glüht man reines salpetersaures Kali mit zerschnittenem dünnen Kupferblech in einem kupfernen Tiegel und laugt die erkaltete Masse mit Wasser aus. K. ist weiß, kristallinisch, spez. Gew. 2,1, sehr zerfließlich, absorbiert begierig Kohlensäure, löst sich leicht in Wasser und Alkohol, reagiert alkalisch, schmeckt sehr stark ätzend, schmilzt bei Rotglut, verflüchtigt sich bei höherer Temperatur, zerstört die meisten Pflanzen- und Tierstoffe und fühlt sich, weil es sofort die Haut angreift, zwischen den Fingern schlüpfrig an; es verseift Fette und verwandelt Holzfaser beim Schmelzen in Oxalsäure. K. zeigt sehr stark basische Eigenschaften, bildet mit Säuren die Kalisalze und fällt die meisten Metalle aus ihren Lösungen als Metallhydroxyde. Man benutzt es zur Bereitung von Schmierseife, Oxalsäure, zum Absorbieren von Kohlensäure aus Gasen, zum Trocknen von Gasen und Flüssigkeiten, als kräftiges Ätzmittel zum Zerstören von Warzen, zum Öffnen von Abszessen, zur Bildung künstlicher Geschwüre, zum Beizen vergifteter Wunden, von Schanker und Bubonen. Kalilauge wurde in der Technik früher viel häufiger als jetzt benutzt, wo man sie in den meisten Fällen, sobald es sich nämlich nur um ihre stark basischen Eigenschaften handelt, durch die billigere Natronlauge, auch durch Ammoniak ersetzt.
http://www.zeno.org/Meyers-1905. 1905–1909.