- Chemische Formeln
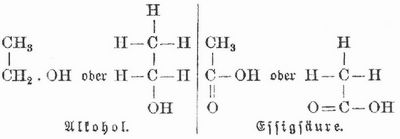
Chemische Formeln, die mit Hilfe der Chemischen Zeichen (s.d.) hergestellten Symbole der Zusammensetzung chemischer Verbindungen. Die Formel H2SO4 kommt der Schwefelsäure zu und besagt, daß dieser Körper aus 2 Atomen Wasserstoff, 1 Atom Schwefel und 4 Atomen Sauerstoff besteht, und zwar bedeutet die Formel 1 Molekül der Schwefelsäure. Nun sind 2 Atome Wasserstoff = 1,01 × 2 = 2,02, 1 Atom Schwefel = 32,06 u. 4 Atome Sauerstoff = 16 × 4 = 64, mithin ist das Molekulargewicht der Schwefelsäure 98,08. Daraus berechnet sich dann auch leicht die prozentische Zusammensetzung. Im Gegensatze zur empirischen Formel, die nichts angibt als die Alame und deren Zahl im Molekül einer Verbindung, also die qualitative und quantitative Zusammensetzung desselben, läßt die rationelle oder Konstitutionsformel auch die Gruppierung der Atome im Molekül erkennen. Die empirische Formel des Essigäthers ist C4H8O2. Die in ihm enthaltenen Atome bilden aber zwei Gruppen, nämlich C2H3O2 und C2H5, die bei vielen Zersetzungen des Essigäthers zum Vorschein kommen, und dem Essigäther kommt daher die rationelle Formel C2H3O2.C2H5 zu, die einen Einblick in die »chemische Konstitution« des Körpers gewährt und ihn von einem andern, dem gleichfalls die empirische Formel C4H8O2 zukommt, unterscheidet. Noch bessern Einblick in die Zusammensetzung der Körper gewähren die Strukturformeln, die die Verkettung der Atome im Molekül oder die Struktur des Moleküls erkennen lassen. Die Strukturformeln für Alkohol u. Essigsäure:
besagen, daß im Molekül Alkohol zwei vierwertige Kohlenstoffatome durch eine Verwandtschaftseinheit miteinander verbunden sind. Die drei übrigen Verwandtschaftseinheiten des einen Kohlenstoffatoms binden 3 Atome Wasserstoff, die des andern Kohlenstoffatoms binden 2 Atome Wasserstoff und ein zweiwertiges Sauerstoffatom, das noch 1 Atom Wasserstoff bindet. In der Essigsäure ist das eine Kohlenstoffatom durch 2 Verwandtschaftseinheiten mit 1 Atom Sauerstoff verbunden. Um den Verlauf eines chemischen Prozesses auszudrücken, werden die Formeln zu Gleichungen verbunden. Man verbindet auf der einen Seite die Molekularformeln der auseinander einwirkenden Körper durch ein + und auf der andern ebenso die gebildeten Produkte: H2SO4 + Fe = FeSO4 + 2H. Berechnet man aus den Atomgewichten der betreffenden Elemente die Molekulargewichte der Verbindungen, so ergeben sich ohne weiteres die quantitativen Verhältnisse, die bei diesem Prozeß obwalten. Vgl. Atomverkettung und Stereochemie.
http://www.zeno.org/Meyers-1905. 1905–1909.