- Arsenwasserstoff
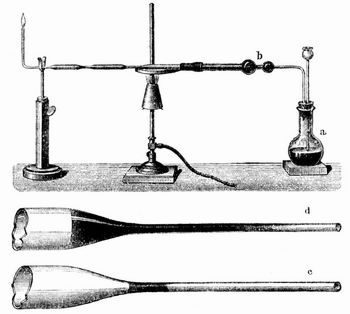
Arsenwasserstoff AsH3 entsteht, wenn bei Entwickelung von Wasserstoff aus Schwefelsäure oder Salzsäure und Zink eine lösliche Arsenverbindung zugegen ist. Arsenhaltige Salz- oder Schwefelsäure entwickelt mit Zink oder Eisen arsenwasserstoffhaltiges Wasserstoffgas. Es soll sich auch aus arsenhaltigen Farben an feuchten, mit Schimmel bedeckten Wänden entwickeln. Rein erhält man es bei Zersetzung von Arsennatrium mit Wasser. Farbloses, knoblauchartig riechendes Gas vom spez. Gew. 2,99 wird bei -40° flüssig und siedet bei -55°, erstarrt bei -113°, ist wenig löslich in Wasser und verbrennt mit bläulicher Flamme zu arseniger Säure und Wasser. Mit Metallsalzen bildet es Arsenmetalle, mit Silbernitrat gelbes Arsensilbernitrat Ag6As(NO3)3, das durch Wasser schwarz wird. A. ist sehr giftig und wirkt höchst heimtückisch. Auf kaltem Porzellan bildet die Flamme dunkle Flecke von metallischem Arsen (Arsenspiegel). Diese Flecke entstehen, wenn man A. durch ein Glasrohr leitet und dies an einer Stelle zum Glühen erhitzt. Hierauf beruht eine sehr empfindliche Methode, Arsen nachzuweisen. Man bringt in die Gasentwickelungsflasche a des Marshschen Apparates (s. Abbildung) die zu untersuchende Flüssigkeit mit reiner Schwefelsäure und reinem Zink, trocknet das entweichende Gas im Chlorcalciumrohr b, erzeugt dann in dem Gasleitungsrohr durch Erhitzen den Spiegel (c d), entzündet das ausströmende Gas, bildet auch auf Porzellan Spiegel und untersucht diese, um sie von ähnlichen Antimonspiegeln, die Antimonwasserstoff unter denselben Verhältnissen liefert, zu unterscheiden.
In dieser Weise läßt sich noch 0,01 mg Arsen nachweisen.
http://www.zeno.org/Meyers-1905. 1905–1909.