- Mariottesches Gesetz
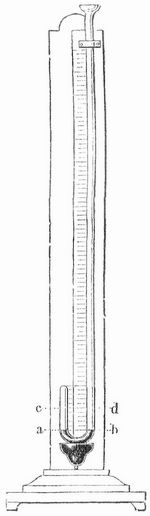
Mariottesches Gesetz (Boylesches Gesetz) sagt aus, daß der Druck, den eine Luftmenge ausübt, im umgekehrten Verhältnis steht zu ihrem Rauminhalt oder im geraden Verhältnis zu ihrem spezifischen Gewicht (zu ihrer Dichte). Um die Zunahme des Druckes beim Zusammenpressen der Luft messend zu verfolgen, kann man sich einer zweischenkeligen Glasröhre (Fig. 1) bedienen, deren kürzerer Schenkel zugeschmolzen, der längere aber offen ist.
Gießt man durch letztern etwas Quecksilber ein, so daß dasselbe die Biegung erfüllt und in beiden Schenkeln gleich hoch steht (bis ab), so übt die im kürzern Schenkel abgesperrte Luft offenbar denselben Druck aus wie die in den offenen Schenkel hereinwirkende äußere Luft. Wird nun noch mehr Quecksilber in den offenen Schenkel gegossen, so steigt dasselbe in beiden Schenkeln, im kürzern Schenkel jedoch viel langsamer, indem es die daselbst eingesperrte Luftmenge zusammendrückt. Wenn diese Luftmenge gerade auf die Hälfte ihres anfänglichen Rauminhalts zusammengepreßt ist (bis c), so findet man, daß die im längern Schenkel ausgegossene Quecksilbersäule, vom Quecksilberniveau (c d) im kürzern Schenkel aus gerechnet, gerade so hoch ist wie die Quecksilbersäule in einem gleichzeitig beobachteten Barometer (s. d.). Der Druck der abgesperrten Luft hält also jetzt außer dem Druck der Atmosphäre, der nach wie vor in das offene Rohr herein wirkt, auch noch dem Druck dieser Quecksilbersäule, der bekanntlich dem Druck der Atmosphäre gleich ist, das Gleichgewicht; die auf die Hälfte ihres ursprünglichen Raumes eingeengte Luft übt also einen doppelt so großen Druck aus als vorher, nämlich einen Druck, der doppelt so groß ist wie der Druck der Atmosphäre, oder der, wie man sich auszudrücken pflegt, 2 Atmosphären beträgt. Wird die Luft im geschlossenen Schenkel durch weiteres Eingießen von Quecksilber auf ein Drittel ihres anfänglichen Raumes zusammengedrängt, so trägt sie außer dem äußern Luftdruck eine Quecksilbersäule von doppelter Barometerhöhe, also im ganzen einen Druck von 3 Atmosphären u. s. s. Arago und Dulong haben auf diese Weise mittels einer Röhre, die, an einem Mastbaum befestigt, sich in einem Turm des Collège Henri IV zu Paris erhob, das Boylesche Gesetz für atmosphärische Luft bis zu einem Druck von 27 Atmosphären geprüft und richtig gefunden. Amagat (1881) setzte die Untersuchungen in einem Schachte son 400 m Tiefe bei St.-Etienne bis zu 400 Atmosphären fort und später (1893) unter Anwendung des Desgosseschen Manometers (Reduktion des Druckes zur Messung durch zwei Kolben von verschiedener Größe nach dem Prinzip der hydraulischen Presse) bis zu 3000 Atmosphären. Dabei ergaben sich Abweichungen, insofern bei hohen Drucken das Volumen langsamer abnimmt (s. Gase, S. 363). Um die Gültigkeit des Gesetzes auch für Drucke unter einer Atmosphäre darzutun, kehrt man eine am einen Ende zugeschmolzene Glasröhre, die außer Quecksilber noch etwas Luft enthält, in einem tiefen, mit Quecksilber gefüllten Gefäß um und drückt sie zuerst so weit hinab, daß das Quecksilber in der Röhre ebensohoch steht wie außen (Fig. 2); die Luft in der Röhre besitzt alsdann denselben Druck wie die äußere, nämlich den einer Atmosphäre. Zieht man nun die Röhre in die Höhe, so dehnt sich die innere Luft aus, und man bemerkt gleichzeitig, daß das Quecksilber in der Röhre in die Höhe steigt. Dies zeigt an, daß der Druck der innern Luft geringer geworden ist, denn der äußere, auf die Oberfläche des Quecksilbers im Gefäß wirkende Luftdruck vermag jetzt außer dem Druck der innern Luft auch noch demjenigen der gehobenen Quecksilbersäule das Gleichgewicht zu halten. Hat man die Röhre so weit herausgezogen, daß die innere Luft einen doppelt so großen Raum einnimmt wie anfangs, so findet man, daß die nachgestiegene Quecksilbersäule gerade halb so hoch ist wie die in einem gleichzeitig beobachteten Barometer und sonach den Druck einer halben Atmosphäre darstellt. Der Druck der aufs Doppelte ausgedehnten Luft muß also ebenfalls, da er im Verein mit demjenigen der Quecksilbersäule dem ganzen auf der Quecksilberfläche des Gefäßes lastenden Atmosphärendruck das Gleichgewicht hält, 1/2 Atmosphäre betragen. Dehnt man durch weiteres Herausziehen die Luft in der Röhre auf das Dreifache aus, so mißt die gehobene Quecksilbersäule 2/3 der Barometerhöhe, woraus hervorgeht, daß der Druck der Luft im Innern nur noch 1/3 Atmosphäre beträgt, u. s. f.
http://www.zeno.org/Meyers-1905. 1905–1909.